cho 15,15g hỗn hợp Al và Zn tác dụng với dung dịch HCl dư thấy có 10,08L khí H2 bay ra đktc.Thành phần phần trăm khối lượng của Zn tròn hỗn hợp ban đầu

Những câu hỏi liên quan
Cho 4,45 gam hỗn hợp bột Zn, Mg tác dụng với dung dịch HCl dư thấy có 2,24 lít khí H2 bay ra (đktc). Khối lượng Zn trong hỗn hợp là:
A. 3,25
B. 4
C. 1,2
D. 1,625
Đáp án A.
Gọi nZn = a , nMg = b (mol)
Zn + 2HCl→ ZnCl2 + H2
a → a (mol)
Mg + 2HCl→ MgCl2 + H2
b b (mol)
Ta có: 65a + 24b = 4,45
a + b = 0,1
Giải ra ta có a = b = 0,05
mZn = 0,05.65 = 3,25 (g)
Đúng 0
Bình luận (0)
Câu 3 : Cho 11,9 gam hỗn hợp gồm 2 kim loại Zn và Al tác dụng với dd HCl dư thấy thoát ra 9,916 lít khí H2 (đkc). a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu. b) Tính khối lượng muối tạo thành. c) Tính khối lượng dung dịch HCl 10% cần dùng
a, Ta có: 65nZn + 27nAl = 11,9 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ mZn = 0,1.65 = 6,5 (g)
mAl = 0,2.27 = 5,4 (g)
b, Theo PT: nZnCl2 = nZn = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
⇒ m muối = 0,1.136 + 0,2.133,5 = 40,3 (g)
c, Theo PT: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{10\%}=292\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 16,7 gam hỗn hợp Al, Fe, Zn tác dụng với NaOH dư thấy thoát ra 5,04 lít khí (đktc) và một phần chất rắn không tan. Lọc lấy phần không tan hòa tan hết bằng dung dịch HCl dư (không có không khí) thấy thoát ra 2,24 lít (đktc). % khối lượng Al trong hỗn hợp là A. 58,38% B. 24,25% C. 16,17% D. 8,08%
Đọc tiếp
Cho 16,7 gam hỗn hợp Al, Fe, Zn tác dụng với NaOH dư thấy thoát ra 5,04 lít khí (đktc) và một phần chất rắn không tan. Lọc lấy phần không tan hòa tan hết bằng dung dịch HCl dư (không có không khí) thấy thoát ra 2,24 lít (đktc). % khối lượng Al trong hỗn hợp là
A. 58,38%
B. 24,25%
C. 16,17%
D. 8,08%
Khi cho hỗn hợp Al, Fe, Zn vào dung dịch NaOH dư thì chỉ có Zn và Al tham gia phản ứng tạo H2(0,225 mol), phần chất rắn không tan là Fe
Cho Fe phản ứng với lượng dư HCl tạo ra 0,1 mol khí → nFe = nH2 = 0,1 mol → mAl + mZn= 16,7- 5,6 = 11,1
Gọi số mol của Al và Zn lần lượt là x, y
Ta có hệ 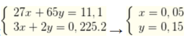
→ %Al = 0 , 05 . 27 16 , 7 ×100% = 8,08 %.
Đáp án D
Đúng 0
Bình luận (0)
Cho 1 lượng hỗn hợp Mg, Al tác dụng với dung dịch HCl dư thu được 10,08l khí H2 (đktc). Mặt khác. cũng lượng hỗn hợp trên tác dụng với dung dịch NaOH dư thì thu được 6,72l H2 (đktc). Tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu đã dùng.
- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)
Đúng 2
Bình luận (0)
cho 3,79 (G) hỗn hợp Zn và Al tác dụng với dung dịch H2SO4 loãng dư .Sau phản ứng thu được 1,792 lít khí (đktc)
a)tính khối lượng mỗi kim loại
b) tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu
PTHH:
Zn + H2SO4 ---> ZnSO4 + H2 (1)
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2 (2)
Ta có: \(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
Gọi x, y lần lượt là số mol của Zn và Al
a. Theo PT(1): \(n_{H_2}=n_{Zn}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}y\left(mol\right)\)
=> \(x+\dfrac{3}{2}y=0,8\) (*)
Theo đề, ta có: 65x + 27y = 3,79 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+\dfrac{3}{2}y=0,8\\65x+27y=3,79\end{matrix}\right.\)
(Ra số âm, bn xem lại đề nhé.)
Đúng 0
Bình luận (0)
Khi cho 24,87 gam hỗn hợp Si, Zn và Fe tác dụng với dung dịch NaOH dư thu được 8,736 lít khí (đktc). Cũng lượng hỗn hợp đó khi tác dụng với dư dung dịch HCl sinh ra 8,064 lít khí (đktc). Phần trăm khối lượng của Si trong hỗn hợp là: A. 13,51%. B. 39,20%. C. 6,76%. D. 47,29%.
Đọc tiếp
Khi cho 24,87 gam hỗn hợp Si, Zn và Fe tác dụng với dung dịch NaOH dư thu được 8,736 lít khí (đktc). Cũng lượng hỗn hợp đó khi tác dụng với dư dung dịch HCl sinh ra 8,064 lít khí (đktc). Phần trăm khối lượng của Si trong hỗn hợp là:
A. 13,51%.
B. 39,20%.
C. 6,76%.
D. 47,29%.
Cho hỗn hợp Al và Mg tác dụng hết với dung dịch HCl dư, thấy bay ra 2,24 lít H2 (đktc). Cũng cho lượng hỗn hợp trên tác dụng với dung dịch NaOh dư thu được 1,2g chất rắn không tan. Tính thành phần phần trăm các kim loại trong hỗn hợp.
\(m_{Mg}=1,2\left(g\right)\)
=> \(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
____0,05--------------------->0,05
2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{30}\)<--------------------0,05
=> \(m_{Al}=\dfrac{1}{30}.27=0,9\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,9}{0,9+1,2}.100\%=42,857\%\\\%Mg=\dfrac{1,2}{0,9+1,2}.100\%=57,143\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho 17,7 gam hỗn hợp Zn và Al tác dụng với dung dịch \(H_2SO_4\) thoát ra 5,6 lít khí \(H_2\) (đktc)
1. Viết các phương trình phản ứng xảy ra
2. Tính thành phần phần trăm theo khối lượng mối kim loại trong hỗn hợp ban đầu
1. \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2. Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\) ⇒ 65x + 27y = 17,7 (1)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y=\dfrac{5,6}{22,4}=0,25\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{66}{235}\\y=-\dfrac{29}{1410}\end{matrix}\right.\)
Tới đây thì ra số mol âm, bạn xem lại đề nhé.
Đúng 0
Bình luận (0)
Cho 13,8 gam hỗn hợp kim loại gồm Fe và Al tác dụng với dung dịch NaOH dư tạo ra 6,72 lít khí H2 (đktc). Phần trăm khối lượng của Fe trong hỗn hợp ban đầu là A. 60,87% B. 58,69% C. 39,13% D. 41,30%
Đọc tiếp
Cho 13,8 gam hỗn hợp kim loại gồm Fe và Al tác dụng với dung dịch NaOH dư tạo ra 6,72 lít khí H2 (đktc). Phần trăm khối lượng của Fe trong hỗn hợp ban đầu là
A. 60,87%
B. 58,69%
C. 39,13%
D. 41,30%
Đáp án A
nH2(ĐKTC) = 6,72:22,4 = 0,3 (mol)
Khi cho Fe và Al pư với dd NaOH chỉ có Al tham gia pư
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
0,2 ← 0,3 (mol)
=> nAl = 0,2 (mol) => mAl = 0,2.27 = 5,4 (g)
=> mFe = 13,8 – 5,4 = 8,4 (g)
%Fe = (8,4: 13,8).100% = 60,87%
Đúng 0
Bình luận (0)















