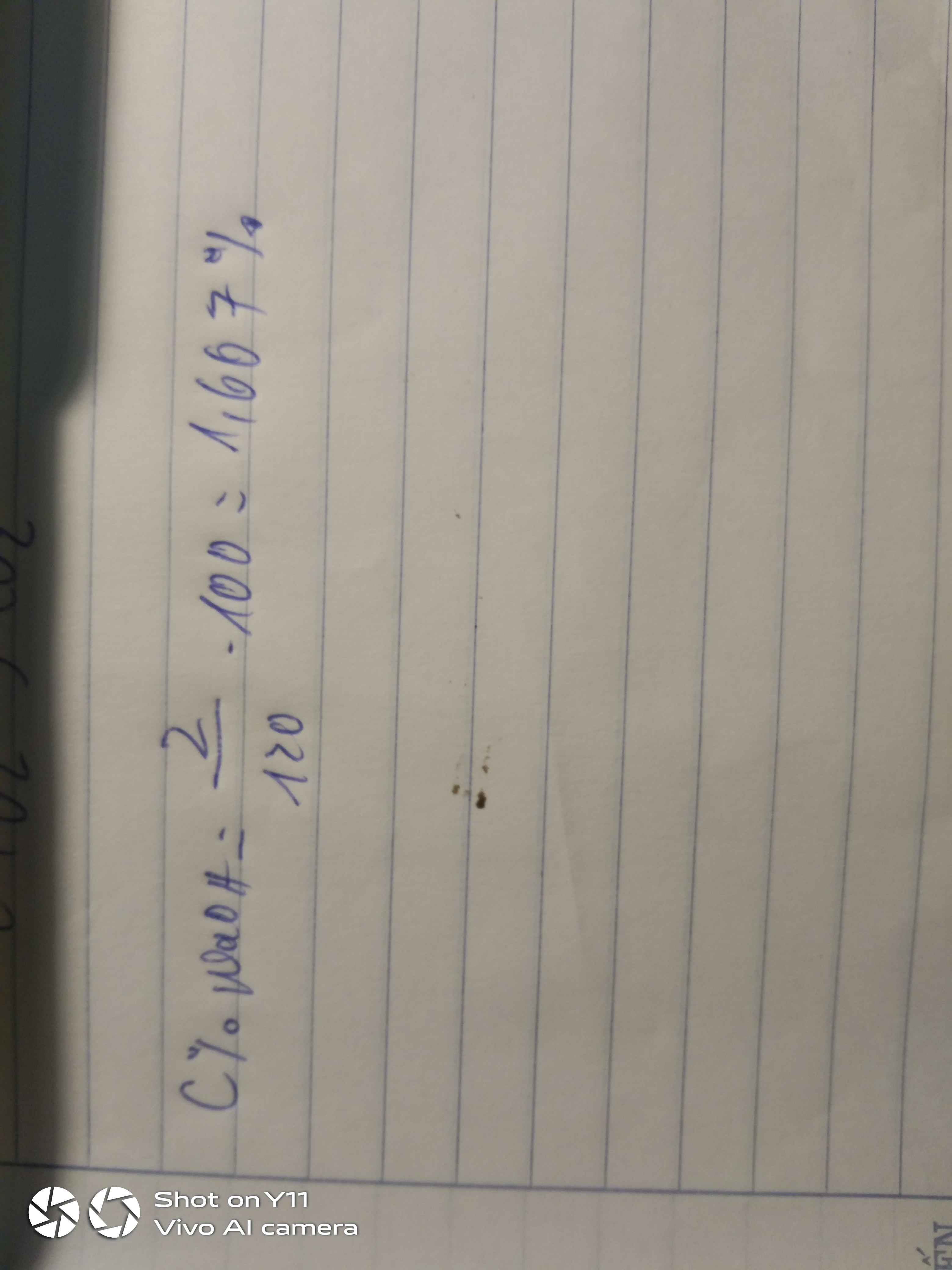Hòa tan 4,6 gam Na vào 120 gam nước thu được dung dịch A. Tính C% của dung dịch A

Những câu hỏi liên quan
a. Hòa tan 3,1 gam Na2O vào 50 gam nước. Tính C% của dung dịch thu được? b. Hòa tan hoàn toàn 4,6 gam Na vào 95,6 gam nước. Tính C% của dung dịch thu được ?
Đọc tiếp
a. Hòa tan 3,1 gam Na2O vào 50 gam nước. Tính C% của dung dịch thu được?
b. Hòa tan hoàn toàn 4,6 gam Na vào 95,6 gam nước. Tính C% của dung dịch thu được ?
a, \(Na_2O+H_2O\rightarrow2NaOH\)
Ta có: \(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
Theo PT: \(n_{NaOH}=2n_{Na_2O}=0,1\left(mol\right)\)
m dd sau pư = 3,1 + 50 = 53,1 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,1.40}{53,1}.100\%\approx7,53\%\)
b, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{H_2}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\end{matrix}\right.\)
Ta có: m dd sau pư = 4,6 + 95,6 - 0,1.2 = 100 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,2.40}{100}.100\%=8\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 4,6 gam Na vào 120,6 gam nước thu được dung dịch X.
Tính C% chất tan trong dung dịch sau phản ứng.
$n_{Na} = \dfrac{4,6}{23} = 0,2(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$n_{H_2} = \dfrac{1}{2}n_{Na} = 0,1(mol)$
$n_{NaOH} = n_{Na} = 0,2(mol)$
Sau phản ứng :
$m_{dd} = 4,6 + 120,6 - 0,1.2 = 125(gam)$
$C\%_{NaOH} = \dfrac{0,2.40}{125}.100\% =6,4\%$
Đúng 3
Bình luận (3)
2Na+ 2H2O→ 2NaOH+ H2
(mol) 0,2 0,2 0,2 0,1 nNa=\(\dfrac{m}{M}=\dfrac{4,6}{23}=0,2\)(mol)
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{120,6}{18}=6,7\)(mol)
Xét tỉ lệ:
Na H2O
\(\dfrac{0,2}{2}\) < \(\dfrac{6,7}{2}\)
=> Na phản ứng hết, nước dư
\(m_{H_2}\)=n.M=0,1.2=0,2(g)
mdd sau phản ứng = mNa+ \(m_{H_2O}\)-\(m_{H_2}\)
= 4,6 +120,6 -0,2= 125(g)
mNaOH=n.M= 0,2.40=8(g)
C%NaOH=\(\dfrac{8}{125}.100\%=0,064\%\)
Đúng 0
Bình luận (1)
Số mol của natri
nNa= \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2
2 2 2 1
0,2 0,2
Số mol của natri hidroxit
nNaOH = \(\dfrac{0,2.2}{2}=0,2\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,2. 40
= 8 (g)
Nồng độ phần trăm của natri hidroxit
C0/0NaOH= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{8.100}{4,6+120,6}=6,4\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Hòa tan 4,6 gam Na vào 35,6 gam nước thu được dung dịch X. Nồng độ phần trăm của NaOH trong dung dịch X là
A. 20,00%.
B. 19,90%.
C. 11,50%.
D. 11,44%.
Hòa tan 2 gam NaOH vào 120 gam nước thu được dung dịch A. Tính C% của dung dịch A
\(m_{ddA}=m_{NaOH}+m_{H_2O}=2+120=122\left(g\right)\)
\(C\%_{ddA}=\dfrac{2}{122}.100\simeq1,639\%\)
Đúng 0
Bình luận (0)
a. Tính khối lượng dung dịch thu được khi hòa tan 15 gam NaCl vào 65 gam nước?
b. Ở nhiệt độ 18°C, khi hòa tan hết 53 gam Na₂CO₃ vào 250 gam nước thì được dung dịch bão hòa. Xác định độ tan của muối Na₂CO₃ ở nhiệt độ trên.
a) mdd =15+65=80g
b)
⇒SNa2CO3=\(\dfrac{53}{250}\).100=21,2g
Vậy độ tan của muối Natricacbonat ở 18 độ C là 21,2g
Đúng 1
Bình luận (0)
a. mdd = 15+65 = 80 (g)
b. Độ tan của muối Na2CO3 ở 18^oC là : S = (53 x 100)/250 = 21,2 (gam).
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 4,6 gam Na vào 24 gam nước thu được dung dịch NaOH có nồng độ
A. 12,3%
B. 28,17%
C. 19,78%
D. 13,45%
Đáp án B
nNa = 4,6: 23 = 0,2 mol
- Phản ứng: Na + H2O → NaOH + 0,5H2
Mol 0,2 → 0,2 → 0,1
Bảo toàn khối lượng: mNa + mH2O = mdd + mH2
=> mdd = 4,6 + 24 – 0,1.2 = 28,4g
=> C%NaOH = 0,2.40: 28,4 = 28,17%
Đúng 0
Bình luận (0)
Tính nồng độ % của các chất trong dung dịch thu được trong các thí nghiệm sau:
a/ Hòa tan hết 12,4 gam Na2O vào 50 gam nước.
b/ Hòa tan hết hỗn hợp gồm 16 gam NaOH và 4,6 gam Na vào 100 gam nước.
c/ Cho 9,2 gam Na vào 100 gam dung dịch HCl 7,3%.
a, \(n_{Na_2O}=\dfrac{12,4}{62}=0,2\left(mol\right)\)
PTHH: Na2O + H2O ---> 2NaOH
0,2------------------>0,4
\(\Rightarrow C\%_{NaOH}=\dfrac{0,4.40}{12,4+50}.100\%=25,64\%\)
b, \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2H2O ---> 2NaOH + H2
0,2------------------->0,2------->0,1
\(\Rightarrow C\%_{NaOH}=\dfrac{0,2.40+16}{100+16+4,6-0,1.2}.100\%==20\%\)
c, \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(n_{HCl}=\dfrac{100.7,3\%}{36,5}=0,2\left(mol\right)\)
PTHH:
2Na + 2HCl ---> 2NaCl + H2
0,2<-----0,2-----------0,2--->0,1
2Na + 2H2O ---> 2NaOH + H2
0,2------------------>0,2----->0,1
\(\Rightarrow m_{dd}=9,2+100-\left(0,1+0,1\right).2=108,8\left(g\right)\\ \Rightarrow\left\{{}\begin{matrix}C\%_{NaCl}=\dfrac{0,2.58,5}{108,8}.100\%=10,75\%\\C\%_{NaOH}=\dfrac{0,2.40}{108,8}.100\%=7,35\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hoà tan 4,6 gam Na vào 100 ml nước thu được dung dich A và V lít khí H2 (đktc).
a) Tính giá trị của V?
b) Tính nồng độ mol của dung dịch A?
c) Tính nồng độ phần trăm của chất tan trong dung dịch A?
a) nNa = 4,6/23 = 0,2 (mol)
PTHH: 2Na + 2H2O -> 2NaOH + H2
Mol: 0,2 ---> 0,2 ---> 0,2 ---> 0,1
VH2 = 0,1 . 22,4 = 2,24 (l)
b) CMNaOH = 0,2/0,1 = 2M
c) mH2O = 100 . 1 = 100 (g)
mNaOH = 0,2 . 40 = 8 (g)
mH2 = 0,1 . 2 = 0,2 (g)
mdd = 100 + 8 - 0,2 = 107,8 (g)
C%NaOH = 8/107,8 = 7,42%
Đúng 2
Bình luận (1)
Hoà tan 4,6 gam Na vào 100 ml nước thu được dung dich A và V lít khí H2 (đktc).
a) Tính giá trị của V?
b) Tính nồng độ mol của dung dịch A?
c) Tính nồng độ phần trăm của chất tan trong dung dịch A?