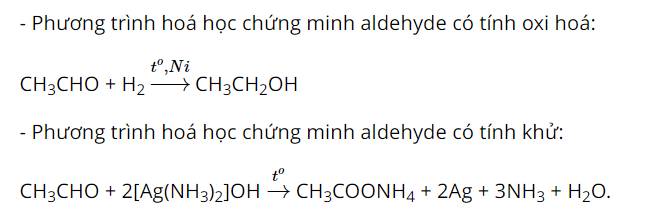viết phương trình chứng minh hcl có tính axit và tính khử

Những câu hỏi liên quan
3) Viết phương trình phản ứng chứng minh – giải thích: a) Nước Clo có tính tẩy màu. b) HCl có tính oxi hóa. c) HCl có tính khử. d) Cl2 vừa có tính khử, vừa có tính oxi hóa (1 phương trình). e) HCl có tính axit, axit HCl mạnh hơn H2CO3.
3) Viết phương trình phản ứng chứng minh – giải thích: HCl có tính oxi hóa. Cl2 vừa có tính khử, vừa có tính oxi hóa (1 phương trình).
Mg + 2HCl -> MgCl2 + H2
Mg có số oxi hoá ban đầu là 0 sau phản ứng lên +2, H có số oxi hoá ban đầu là +1 sau phản ứng còn 0 nên HCl thể hiện tính oxi hoá ở phương trình này
Cl2 + 2NaOH -> NaCl + NaClO + H2O
Cl2 ban đầu có số oxi hoá là 0,sau phản ứng ở NaCl có số oxi hoá là -1 chứng tỏ có tính oxi hoá, ở NaClO có số oxi hoá là +1 chứng tỏ có tính khử
Đúng 16
Bình luận (0)
Viết phương trình chứng minh tính axit của H2SO3 yếu hơn HCl
PTHH: \(K_2SO_3+2HCl\rightarrow2KCl+H_2O+SO_2\uparrow\)
Đúng 1
Bình luận (0)
Carbonic acid is weaker than hydrochloric acid: + If Na2CO3 reacts with HCl, there is a reaction to create NaCl + H2O + CO2 + But if NaCl reacts with H2CO3, it will not create HCl and Na2CO3 => HCl is stronger than H2CO3 Equation (1) also proves that H2CO3 is a weak acid, it decomposes into water and CO2.
tiking me !translate it yourself!
Đúng 1
Bình luận (4)
Viết 2 phương trình chứng minh SO2 vừa có tính khử vừa có tính oxi hóa
\(SO_2+Br_2+2H_2O\rightarrow2HBr+H_2SO_4\) ( tính khử )
\(SO_2+2Mg\rightarrow\left(t^o\right)2MgO+S\) ( tính oxi hóa )
Đúng 3
Bình luận (0)
các chất sau có tính axit,bazo, oxi hoá hay khử. Viết ptrimh chứng minh
cl2, Br2,I2, HCL,S,H2S,SO2,H2SO4,O2, O3
Viết các phương trình phản ứng để chứng minh:
- Kim loại kiềm có tính khử mạnh, tính khử tăng dần khi đi từ Li đến Cs.
- Ion Fe2+ có cả tính oxi hoá, có cả tính khử.
- Ion Fe3+ có tính oxi hóa.
- Kim loại kiềm có tính khử mạnh, tính khử tăng dần khi đi từ Li đến Cs.
=> Xét pứ vs nước và phi kim em nhé
- Ion Fe2+ có cả tính oxi hoá, có cả tính khử.
=>Xét pứ Cu
Fe2++Cuo->Fe0+Cu+2
, Axit đặc
Fe2++H++NO3-2->Fe+3+NO+H2O
- Ion Fe3+ có tính oxi hóa.
=>Xét pứ td vs Fe
Fe+3+Fe0->Fe+2
Đúng 0
Bình luận (0)
Hãy viết các phương trình hoá học để chứng minh các aldehyde vừa có tính oxi hoá, vừa có tính khử.
Dùng V (lít) khí hiđro (ở đktc)khử 8 gam sắt (|||) oxit a) viết phương trình hóa học b) tính thể tích khí hiđro thu được (ở đktc) c) tính khối lượng axit Clohiđric (HCl) đã dùng
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
\(n_{H_2}=3n_{Fe_2O_3}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
c, Đề hỏi mHCl đã dùng khi nào bạn nhỉ?
Đúng 1
Bình luận (0)
Cho 4,8 gam Mg tác dụng hết với dung dịch axit HCL a] Viết phương trình phản ứng b] Tính khối lượng axit HCL đã dùng c] Nếu dùng lượng H2 ở trên để khử 24 gam CuO ở nhiệt độ cao thì thu được bao nhiêu gam đồng kim loại ?
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
c, \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta có: \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
Đúng 1
Bình luận (1)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ a,PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{HCl}=2.0,2=0,4\left(mol\right);n_{H_2}=n_{Mg}=0,2\left(mol\right)\\ b,m_{HCl}=0,4.36,5=14,6\left(g\right)\\ c,n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\\ CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\\ Vì:\dfrac{0,2}{1}< \dfrac{0,3}{1}\Rightarrow CuOdư\\ n_{Cu}=n_{H_2}=0,2\left(mol\right)\\ m_{Cu}=0,2.64=12,8\left(g\right)\)
Đúng 1
Bình luận (0)