Viết các phương trình hóa học xảy ra, tính khối lượng dung dịch sau phản ứng, thể tích dung dịch sau phản ứng và số mol chất tan sau phản ứng :
1. Cho P2O5 vào dd H3PO4
2. Cho P2O5 vào dd KOH
3. Sục SO2 vào dd Na2SO3
4. Sục khí SO2 vào dd Ca(OH)2
5. Sục SO2 vào dd KOH
6. Cho Ba vào dd H2SO4. Tính thể tích H2
7. Cho BaO vào dd H2SO4
8. Cho mẩu Na vào dd CuSO4
9. Cho SO3 vào dd HCl
10. Cho P2O5 vào dd CuCl2
11. Cho Na2O vào dd NaOH
12. Cho SO2 vào dd H2SO4

Những câu hỏi liên quan
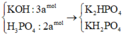
Cho a mol P2O5 vào dung dịch chứa 3a mol KOH. Sau khi phản ứng xảy ra hoàn toàn, dung dịch thu được chứa các chất tan là: A. K3PO4 và KOH. B. H3PO4 và KH2PO4. C. K3PO4 và K2HPO4. D. K2HPO4 và KH2PO4.
Đọc tiếp
Cho a mol P2O5 vào dung dịch chứa 3a mol KOH. Sau khi phản ứng xảy ra hoàn toàn, dung dịch thu được chứa các chất tan là:
A. K3PO4 và KOH.
B. H3PO4 và KH2PO4.
C. K3PO4 và K2HPO4.
D. K2HPO4 và KH2PO4.
hoà tan hoàn toàn 16,25g zn bằng 200ml dd H2SO4 1,5M
a, vt phương trình phản ứng hoá học xảy ra
b, tính thể tích khí thoát ra ở đkt
c, tính khối lượng uối tạo thành sau phản ứng
d, tính nồng độ mol ủa dung dịch sau phản ứng, coi thể tích của dung dịch thay dổi không đáng kể
a. PTHH: Zn + H2SO4 ---> ZnSO4 + H2↑
b. Ta có: \(C_{M_{H_2SO_4}}=\dfrac{n_{H_2SO_4}}{200:1000}=1,5M\)
=> \(n_{H_2SO_4}=0,3\left(mol\right)\)
Ta lại có: \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
Ta thấy: \(\dfrac{0,3}{1}>\dfrac{0,25}{1}\)
Vậy H2SO4 dư.
Theo PT: \(n_{H_2}=n_{Zn}=0,25\left(mol\right)\)
=> \(V_{H_2}=0,25.22,4=5,6\left(lít\right)\)
c. Theo PT: \(n_{ZnSO_4}=n_{Zn}=0,25\left(mol\right)\)
=> \(m_{ZnSO_4}=0,25.161=40,25\left(g\right)\)
d. Ta có: \(V_{dd_{ZnSO_4}}=0,2\left(lít\right)\)
=> \(C_{M_{ZnSO_4}}=\dfrac{0,25}{0,2}=1,25M\)
Đúng 3
Bình luận (0)
Cho một lá sắt có khối lượng 5gam vào 50ml dung dịch CuSO4 15% có khối lượng riêng 1,12g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô cân nặng 5,16g.1. Viết phương trình hóa học2. Tính số mol CuSO4 còn dư trong dung dịch sau phản ứng3. Tính nồng độ mol của các chất có trong dung dịch sau phản ứng. Biết thể tích dung dịch thay đổi không đáng kể
Đọc tiếp
Cho một lá sắt có khối lượng 5gam vào 50ml dung dịch CuSO4 15% có khối lượng riêng 1,12g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô cân nặng 5,16g.
1. Viết phương trình hóa học
2. Tính số mol CuSO4 còn dư trong dung dịch sau phản ứng
3. Tính nồng độ mol của các chất có trong dung dịch sau phản ứng. Biết thể tích dung dịch thay đổi không đáng kể
trên mạng mk thấy có một bài tượng tự trên hocmai, bạn vào đó tham khảo nhé
Đúng 0
Bình luận (2)
Cho 2,4 g bột sắt vào 250 ml dung dịch CuCl2 0,2M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và chất rắn
a/ Viết phương trình hóa học
b/ Tính khối lượng chất rắn thu được sau phản ửng
c/ Xác định nồng độ mol của các chất tan trong dung dịch A. Giả thiết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể.
Đọc tiếp
Cho 2,4 g bột sắt vào 250 ml dung dịch CuCl2 0,2M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và chất rắn
a/ Viết phương trình hóa học
b/ Tính khối lượng chất rắn thu được sau phản ửng
c/ Xác định nồng độ mol của các chất tan trong dung dịch A. Giả thiết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể.
Câu 2: Cho 200ml dung dịch KOH 1M tác dụng với 300ml dung dịch H2SO4 1M.
a/ Viết PTHH của phản ứng xảy ra?
b/ Tính khối lượng chất dư sau Phản ứng?
c/ Tính thể tích dung dịch sau phản ứng?
d/ Tính nồng độ mol của các chất trong dung dịch sau phản ứng
a/ \(n_{KOH}=0,2.1=0,2\left(mol\right);n_{H_2SO_4}=0,3.1=0,3\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + 2H2O
Mol: 0,2 0,1 0,1
Ta có: \(\dfrac{0,2}{2}< \dfrac{0,3}{1}\) ⇒ KOH hết, H2SO4 dư
b/ \(m_{H_2SO_4dư}=\left(0,3-0,1\right).98=19,6\left(g\right)\)
c/ Vdd sau pứ = 0,2 + 0,3 = 0,5 (l)
d/ \(C_{M_{ddK_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
\(C_{M_{ddH_2SO_4dư}}=\dfrac{0,3-0,1}{0,5}=0,4M\)
Đúng 4
Bình luận (0)
Cho m gam P2O5 vào 19,60 gam dung dịch H3PO4 5% thu được dung dịch X. Cho dung dịch X phản ứng hết với 100 ml dung dịch KOH 1M thu được dung dịch Y. Cô cạn dung dịch Y thu được 6,48 gam chất rắn khan. a) Viết phương trình hóa học của các phản ứng có thể xảy ra. b) Tính khối lượng các chất có trong 6,48 gam chất rắn và giá trị m.
a. Các phản ứng có thể xảy ra :
P2O5 + 3H2O -> 2H3PO4
KOH + H3PO4 -> KH2PO4 + H2O
2KOH + H3PO4 -> K2HPO4 + 2H2O
3KOH + H3PO4 -> K3PO4 + 3H2O
b.Gọi nP2O5 = x mol
=> nH3PO4(X) = 0,01+ 2x (mol)
, nKOH = 0,1 mol
+) TH1 : Nếu KOH dư => chất rắn gồm : (0,01 + 2x) mol K3PO4 ; (0,07 – 6x) mol KOH
=> 6,48 = 212(0,01 + 2x) + 56(0,07 – 6x) => x = 0,005 mol => m = 0,71g
=> 6,48g X gồm : 4,24g K3PO4 và 2,24g KOH
+) TH2 : Nếu chất rắn gồm : (0,08 – 2x) mol K3PO4 ; (4x – 0,07) mol K2HPO4
, mK3PO4 < 6,48g => 0,08 – 2x < 0,03 => x > 0,025
=> 6,48 = 212(0,08 - 2x) + 174(4x – 0,07) => x = 0,00625 mol (L)
+) TH3 : Nếu chất rắn gồm : (0,09 - 2x) mol K2HPO4 ; (4x – 0,08) mol KH2PO4
,mK2HPO4 < 6,48g => 0,09 – 2x < 0,037 => x > 0,043
=> 6,48 = 174(0,09 - 2x) + 136(4x – 0,08) => x = 0,0086 mol (L)
+) TH4 : Nếu H3PO4 dư => nKH2PO4 = 0,1 mol => mKH2PO4 = 13,6g > 6,48g (L)
Đúng 0
Bình luận (0)
Cho 6,5 g kẽm vào 300ml dung dịch H2SO4 loãng có nồng độ 1M
a. Viết phương trình phản ứng xảy ra.
b. Tính số mol các chất có trong dung dịch sau phản ứng.
c. Tính nồng độ mol của các chất sau phản ứng. Coi thể tích dung dịch không đổi.
Help. Mai thi hóa r :(
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{H_2SO_4}=0.3\cdot1=0.3\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1........0.1...........0.1.......0.1\)
\(\Rightarrow H_2SO_4dư\)
\(n_{H_2SO_4\left(dư\right)}=0.3-0.1=0.2\left(mol\right)\)
\(n_{ZnSO_4}=n_{H_2}=0.1\left(mol\right)\)
\(C_{M_{ZnSO_4}}=\dfrac{0.1}{0.3}=0.33\left(M\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2}{0.3}=0.66\left(M\right)\)
Đúng 2
Bình luận (0)
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ b) n_{Zn} = \dfrac{6,5}{65} = 0,1 < n_{H_2SO_4} =0,3 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} = n_{ZnSO_4} = n_{Zn} = 0,1(mol)\\ n_{H_2SO_4\ dư} = 0,3 - 0,1 = 0,2(mol)\\ c) C_{M_{ZnSO_4}} = \dfrac{0,1}{0,3} = 0,33M\\ C_{M_{H_2SO_4}} = \dfrac{0,2}{0,3} = 0,67M\)
Đúng 0
Bình luận (0)
\(n_{Zn}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(n_{H2SO4}=C_M.V=0,3\left(mol\right)\)
a, \(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b, Thấy 0,3 > 0,1
=> Sau phản ứng Zn hết, H2SO4 còn dư ( dư 0,3 - 0,1 = 0,2 mol )
- Theo PTHH : \(n_{ZnSO4}=n_{Zn}=0,1\left(mol\right)\)
c, Ta có : \(\left\{{}\begin{matrix}C_{MH2SO4}=\dfrac{n}{V}=\dfrac{2}{3}M\\C_{MZnSO4}=\dfrac{n}{V}=\dfrac{1}{3}M\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Trộn 40 ml dung dịch có chứa 16 g CuSO4 với 60 ml dung dịch có chứa 12 g NaOH a Viết phương trình phản ứng xảy ra b Tính khối lượng chất rắn thu được sau phản ứng c tính nồng độ mol các chất tan có trong dung dịch sau phản ứng? cho rằng thể tích của dung dịch không thay đổi đáng kể
Câu 2:
1/ Nêu hiện tượng và viết phương trình phản ứng hóa học xảy ra khi cho lần lượt các chất: Na, Cu, Cao, SO2, P2O5, MgO vào nước sau đó nhúng mẩu giấy quỳ vào dung dịch tạo thành.
2/ Có 5 chất rắn đựng riêng biệt sau: Na, Na2O, P2O5, CaCO3, NaCl. Hãy nêu cách nhận ra mỗi chất. Viết phương trình phản ứng để giải thích
Câu 2:
1/ - Na: Na tan, có khí thoát ra, giấy quỳ chuyển xanh.
PT: \(Na+2H_2O\rightarrow2NaOH+H_2\)
- Cu: không tan
- CaO: tan, tỏa nhiệt, giấy quỳ chuyển xanh.
PT: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
- SO2: tan, giấy quỳ chuyển đỏ.
PT: \(SO_2+H_2O⇌H_2SO_3\)
- P2O5: tan, giấy quỳ chuyển đỏ.
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
- MgO: không tan.
2/ - Trích mẫu thử.
- Hòa tan từng mẫu thử vào nước có quỳ tím.
+ Không tan: CaCO3.
+ Tan, quỳ tím chuyển đỏ: P2O5.
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
+ Tan, có khí thoát ra, quỳ tím chuyển xanh: Na
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
+ Tan, quỳ tím chuyển xanh: Na2O.
PT: \(Na_2O+H_2O\rightarrow2NaOH\)
+ Tan, quỳ tím không đổi màu: NaCl.
- Dán nhãn.
Đúng 2
Bình luận (0)
1. Hòa tan hoàn toàn một lượng P2O5 vào 200 gam dung dịch H3PO4 10%. Sau đó phản ứng thu được dung dịch H3PO4 17,93%. Tính khối lượng P2O5 đã dùng?
2. Nung m gam thuốc tím chứa 10% tạp chất (không phản ứng) thu được 10,08 lít khí(đktc) thu được hỗn hợp chất rắn X.
a. Tính m biết H = 80%.
b. Tính khối lượng các chất trong hỗn hợp X.
1) Gọi số mol P2O5 là a (mol)
PTHH: P2O5 + 3H2O --> 2H3PO4
a----------------->2a
\(m_{H_3PO_4\left(tổng\right)}=98.2a+\dfrac{10.200}{100}=196a+20\left(g\right)\)
mdd sau pư = 142a + 200 (g)
=> \(C\%_{dd.sau.pư}=\dfrac{196a+20}{142a+200}.100\%=17,93\%\)
=> a = 0,093 (mol)
=> mP2O5 = 0,093.142 = 13,206 (g)
Đúng 3
Bình luận (0)
2)
a) \(n_{O_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,9<-----------0,45<----0,45<----0,45
=> \(m_{KMnO_4\left(Pư\right)}=0,9.158=142,2\left(g\right)\)
=> \(m_{KMnO_4\left(tt\right)}=\dfrac{142,2.100}{80}=177,75\left(g\right)\)
=> \(m=\dfrac{177,75.100}{90}=197,5\left(g\right)\)
b)
X \(\left\{{}\begin{matrix}m_{K_2MnO_4}=0,45.197=88,65\left(g\right)\\m_{MnO_2}=0,45.87=39,15\left(g\right)\\m_{KMnO_4}=177,75-142,2=35,55\left(g\right)\\m_{tạp.chất}=197,5.10\%=19,75\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)