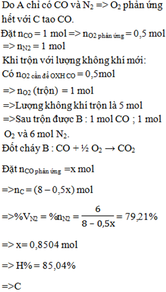Khí A chứa 80% cacbon và 20% hidro; 1 lít khí A (đktc)nặng 1,34gam. Xác định công thức hóa học của A?
b. Đốt một hợp chất trong khí Y sinh ra khí Cacbonic, hơi nước và khí Nitơ. Trong thành phần của Y có nguyên tố nào? Vì sao?

Những câu hỏi liên quan
Xác định công thức phân tử của các chất A, B, C, biết thành phần % khối lượng như sau:
1. Chất A chứa 85,71% Cacbon và 14,29% Hidro; 1 lit khí A ở đktc nặng 1,25gam.
2. Chất B chứa 80% cacbon và 20% là oxi
3. Chất C chứa 40% Cacbon, 6,67% Hidro và còn lại là Oxi, biết C có chứa 2 nguyên tử oxi
1) \(n_A=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)=>M_A=\dfrac{1,25}{\dfrac{5}{112}}=28\left(g/mol\right)\)
\(m_C=\dfrac{85,71.28}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{14,29.28}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
=> CTPT: C2H4
2) Mình nghĩ phải là 80% C và 20% H :v
\(\dfrac{m_C}{m_H}=\dfrac{80\%}{20\%}=4=>\dfrac{12n_C}{n_H}=4=>\dfrac{n_C}{n_H}=\dfrac{1}{3}\)
=> CTPT: (CH3)n hay CnH3n
Xét độ bất bão hòa \(k=\dfrac{2.n+2-3.n}{2}=\dfrac{2-n}{2}\)
=> n = 2 (do k là số nguyên không âm)
=> CTPT: C2H6
3) %O = 100% - 40% - 6,67% = 53,33%
\(M_C=\dfrac{16.2.100}{53,33}=60\left(g/mol\right)\)
\(m_C=\dfrac{60.40}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{6,67.60}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
=> CTPT: C2H4O2
Đúng 0
Bình luận (0)
hợp chất khí A có chứa 90% Cacbon và 10% Hidro biết tỉ khối của khí A so với khí Hidro là 20 tìm công thức hóa học của khí A
Ta có: \(M_A=20.2=40\left(\dfrac{g}{mol}\right)\)
Gọi CTHH của A là: \(\left(C_xH_y\right)_n\)
Ta có: \(x:y=\dfrac{90\%}{12}:\dfrac{10\%}{1}=7,5:10=3:4\)
Vậy CTHH của A là: \(\left(C_3H_4\right)_n\)
Ta có: \(M_A=\left(12.3+1.4\right).n=40\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow n=1\)
Vậy CTHH của A là: C3H4
Đúng 2
Bình luận (0)
Xác định công thức phân tử của các chất có thành phần như sau :
a, chất A chứa 85,71% cacbon, còn lại là hidro, một lít khí A ở đktc nặng 1,25 gam
b, chất B chứa 80% cacbon, và 30% hidro, công thức phân tử trùng với công thức đơn ginả ( biết chỉ số của hidro là số chẵn)
c, chất D chưa 40b% cacbon, 6,67% hidro và oxi: biết mỗi phân tử D chứa 2 nguyên tử oxi
Cho một thể tích không khí (chứa 20% oxi và 80% nitơ về thể tích) cần thiết đi qua bột than đốt nóng, thu được khí A chỉ chứa cacbon oxit và nitơ. Trộn khí A với một lượng không khí gấp 2 lần lượng cần thiết để đốt cháy cacbon oxit, ta được hỗn hợp khí B. Đốt cháy khí B, thu được hỗn hợp C có chứa 79,21% nitơ về thể tích (các thể tích khí và hơi đo ở cùng đk nhiệt độ và áp suất). Hiệu suất phản ứng đốt cháy cacbon oxit là A. 32,52% B. 65,04% C. 85,04% D. 42,52%
Đọc tiếp
Cho một thể tích không khí (chứa 20% oxi và 80% nitơ về thể tích) cần thiết đi qua bột than đốt nóng, thu được khí A chỉ chứa cacbon oxit và nitơ. Trộn khí A với một lượng không khí gấp 2 lần lượng cần thiết để đốt cháy cacbon oxit, ta được hỗn hợp khí B. Đốt cháy khí B, thu được hỗn hợp C có chứa 79,21% nitơ về thể tích (các thể tích khí và hơi đo ở cùng đk nhiệt độ và áp suất). Hiệu suất phản ứng đốt cháy cacbon oxit là
A. 32,52%
B. 65,04%
C. 85,04%
D. 42,52%
Xác định công thức phân tử của các chất A,B,C bk thành phần % khối lượng như sau:
1. Chất A chứ 85,71% Cacbon và 14,29% Hidro; 1 lít khí A ở đktc nặng 1,25 gam
2. Chất B chứa 80% cacbon và 20% là oxi
3. Chất C chứa 40% cacbon , 6,67% Hidro và còn lại là Oxi, bk C có chứa 2 nguyên tử oxi
1) Gọi CTHH là CxHy
\(n_{C_xH_y}=\frac{1}{22,4}\left(mol\right)\)
\(\Rightarrow M_{C_xH_y}=1,25\div\frac{1}{22,4}=28\left(g\right)\)
Ta có: \(12x\div y=85,71\div14,29\)
\(\Rightarrow x\div y=\frac{85,71}{12}\div\frac{14,29}{1}\)
\(\Rightarrow x\div y=7,1425\div14,29\)
\(\Rightarrow x\div y=1\div2\)
CTHH đơn giản là (CH2)n
Ta có: \(14n=28\)
\(n=2\)
Vậy CTHH là C2H4
Đúng 0
Bình luận (0)
3) Gọi CTPT là CxHyO2
\(\%O=100\%-40\%-6,67\%=53,33\%\)
\(M_{C_xH_yO_z}=\frac{2\times16}{53,33\%}=60\left(g\right)\)
Ta có: \(\%C=\frac{12x}{60}\times100\%=40\%\)
\(\Leftrightarrow\frac{12x}{60}=0,4\)
\(\Rightarrow x=\frac{0,4\times60}{12}=2\)
Ta có: \(\%H=\frac{y}{60}\times100\%=6,67\%\)
\(\Leftrightarrow\frac{y}{60}=0,0667\)
\(\Rightarrow y=0,0667\times60=4\)
Vậy CTPT là C2H4O2
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
a. Khí A chứa 80% cacbon và 20% hiđro; 1 lít khí A (ở đkt) nặng 1,34 gam. Xác định công thức hóa học của A?b. Đốt hợp chất Y sinh ra khí cacbonic, hơi nước và khí Nitơ. Cho biết nguyên tố nào bắt buộc có trong thành phần của Y? Nguyên tố nào có thể có, có thể không trong thành phần của Y? Giải thích?c. Cho luồng khí hiđro đi qua ống thủy tinh chứa 10 gam bột đồng (II) oxit ở nhiệt độ cao. Sau phản ứng thu được 8,4 gam chất rắn. Nêu hiện tượng phản ứng. Tính thể tích khí hiđro tham gia phản ứng ở...
Đọc tiếp
a. Khí A chứa 80% cacbon và 20% hiđro; 1 lít khí A (ở đkt) nặng 1,34 gam. Xác định công thức hóa học của A?
b. Đốt hợp chất Y sinh ra khí cacbonic, hơi nước và khí Nitơ. Cho biết nguyên tố nào bắt buộc có trong thành phần của Y? Nguyên tố nào có thể có, có thể không trong thành phần của Y? Giải thích?
c. Cho luồng khí hiđro đi qua ống thủy tinh chứa 10 gam bột đồng (II) oxit ở nhiệt độ cao. Sau phản ứng thu được 8,4 gam chất rắn. Nêu hiện tượng phản ứng. Tính thể tích khí hiđro tham gia phản ứng ở đkt?
a) CTHH: CxHy
\(M_A=\dfrac{1,34}{\dfrac{1}{22,4}}=30\left(g/mol\right)\)
\(m_C=\dfrac{30.80}{100}=24\left(g\right)\Rightarrow x=\dfrac{24}{12}=2\)
\(m_H=\dfrac{30.20}{100}=6\left(g\right)\Rightarrow y=\dfrac{6}{1}=6\)
=> CTHH: C2H6
b)
Y + O2 --to--> CO2 + H2O + N2
Do đốt cháy Y được sản phẩm chứa các nguyên tố C, H, O, N
=> Y bắt buộc phải chứa C, H, N; có thể có O
c) Hiện tượng: Chất rắn màu đen chuyển dần sang màu đỏ
\(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
Gọi số mol CuO pư là a (mol)
PTHH: CuO + H2 --to--> Cu + H2O
a--->a--------->a
=> 80(0,125 - a) + 64a = 8,4
=> a = 0,1 (mol)
=> VH2(đktc) = 0,1.22,4 = 2,24 (l)
Đúng 0
Bình luận (0)
Giúp mk bài nàyBài 1: Một hợp chất Y có nguyên tố cacbon chiếm 80% và 20% là Hidro. Tỉ khối của Y với hidro bằng 15. Xác định CTHH đơn giản của Y.Bài 2: Người ta điều chế oxit kẽm bằng cách đốt bột kẽm trong không khí. Muốn điều chế 20,5g kẽm oxit cần :- Phải đốt bao nhiêu gam bột kẽm.- Bao nhiêu thể tích không khí ở đktc. ( Biết oxi chiếm 1/5 thể tích không khí )- Số phân tử oxi cần dùng để đốt cháy hết kẽm là bao nhiêu ?
Đọc tiếp
Giúp mk bài này
Bài 1: Một hợp chất Y có nguyên tố cacbon chiếm 80% và 20% là Hidro. Tỉ khối của Y với hidro bằng 15. Xác định CTHH đơn giản của Y.
Bài 2: Người ta điều chế oxit kẽm bằng cách đốt bột kẽm trong không khí. Muốn điều chế 20,5g kẽm oxit cần :
- Phải đốt bao nhiêu gam bột kẽm.
- Bao nhiêu thể tích không khí ở đktc. ( Biết oxi chiếm 1/5 thể tích không khí )
- Số phân tử oxi cần dùng để đốt cháy hết kẽm là bao nhiêu ?
CTTQ: \(C_xH_y\)
\(M_Y=15.2=30\left(\dfrac{g}{mol}\right)\)
\(\dfrac{M_C}{M_y}.100\%=80\%\) ⇒ \(\dfrac{12.x}{30}.100\%=80\%\)
⇒ \(x=2\)
\(M_H=30-12.2=6\)
⇒ \(y=6\)
⇒ \(CTHH:C_2H_6\)
Đúng 1
Bình luận (1)
Khis A có tỉ khối so với khí hiđrô là 8. Thành phần theo khối lượng khí A là 75% Cacbon còn lại là Hidro. Hãy tìm thể tích không khi đủ để đốt cháy hoàn toàn 11,2 lít khí A. Biết trong không khi có chứa 20% là khí oxi (các thể tích đo ở dktc)
Gọi CTPT của A là CxHy.
Ta có: \(\dfrac{m_C}{m_H}=\dfrac{75\%}{25\%}\Rightarrow\dfrac{12n_C}{n_H}=\dfrac{75\%}{25\%}\Rightarrow\dfrac{n_C}{n_H}=\dfrac{1}{4}\)
⇒ x:y = 1:4
→ A có CTPT dạng (CH4)n
Mà: \(M_A=8.2=16\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{16}{12+4}=1\)
→ CTPT của A là CH4.
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}=1\left(mol\right)\)
\(\Rightarrow V_{O_2}=1.22,4=22,4\left(l\right)\)
\(\Rightarrow V_{kk}=5V_{O_2}=112\left(l\right)\)
Đúng 2
Bình luận (0)
Điều khẳng định nào sau đây là không đúng? A. Khí oxi nặng gấp 16 lần khí hidro B. Khí nitơ nặng gấp 14 lần khí hidro C. Khí cacbon đioxit nặng gấp 20 lần khí hidro D. Khí cacbonic nặng gấp 1,5 lần không khí
C
\(d_{CO_2/H_2}=\dfrac{44}{2}=22\)
=> Khí CO2 nặng gấp 22 lần khí H2
Đúng 1
Bình luận (0)
1 hợp chất hữu cơ có nguyên tố cacbon chiếm 80 % và 20 % là hidro . tỉ khối của hợp chất với hidro la 15 . tìm công thức hóa học của hợp chất hữu cơ trên
cài nì bn nên đăng lên Cộng đồng học tập miễn phí | Học trực tuyến nha
Đúng 0
Bình luận (0)
hợp chất này gồm: C và H
theo bài ra ta có: C/H = 80/20 =4; và (xC + yH)/ H =15
mà C =12; H =1 vậy công thức của hợp chất này là CH3
cx 100%
Đúng 0
Bình luận (0)