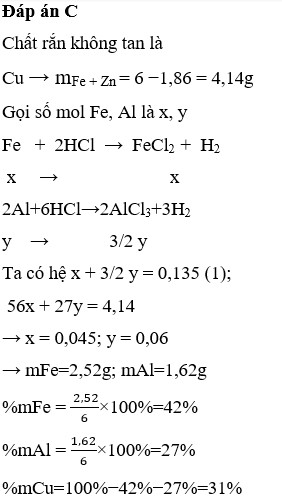Khi hòa tan 6g hợp kim gồm Cu,Fe và Al trong HCl dư thì tạo thành 3,024 lít H2 (đktc) và còn lại 1,86g kim loại không tan.Xác định thành phần % theo khối lượng các kim loại

Những câu hỏi liên quan
Khi hoà tan 6 gam hợp kim gồm Cu, Fe và AI trong axit clohiđric dư thì tạo thành 3,024 lít H 2 (đktc) và còn lại 1,86 gam kim loại không tan. Xác định thành phần phần trăm khối lượng các kim loại.
Khi hoà tan hợp kim gồm 3 kim loại Fe, Cu và Al trong dung dịch HCl dư thì Cu không tác dụng, khối lượng 1,86 gam là khối ỉượng Cu. Gọi số mol Fe là x mol, Al là y mol.
n Fe = x mol
n Al = y mol
n H 2 = 3,024/22,4 = 0,135
Ta có hệ phương trình
56x + 27y = 6 - 1,86 = 4,14
x + 3/2y = 0,135
=> x = 0,045; y = 0,06
m Fe = 0,045 x 56 = 2,52g; n Al = 0,06 x 27 = 1,62g
Từ đó ta tính được thành phần phần trăm khối lượng các kim loại.
Đúng 0
Bình luận (0)
Hòa tan 6 gam hỗn hợp Al, Cu và Fe vào dung dịch HCl thu được 3,024 lít khí H2 ở đktc và còn lại 1,86 gam chất không tan. Xác định thành phần % theo khối lượng của các kim loại trong hỗn hợp ( Biết Cu không tan trong axit )
GIÚP MÌNH VỚI, MÌNH CẦN GẤP !!!!!
Ta có: mCu = 1,86 (g)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Có: mAl + mFe = 6 - 1,86 = 4,14 (g)
Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 4,14 (1)
Ta có: \(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y\left(mol\right)\)
\(\Rightarrow\dfrac{3}{2}x+y=0,135\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,06\left(mol\right)\\y=0,045\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{1,86}{6}.100\%=31\%\\\%m_{Al}=\dfrac{0,06.27}{6}.100\%=27\%\\\%m_{Fe}=42\text{%}\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Chất rắn không tan sau phản ứng là Cu
=> m Cu = 1,86(gam)
Gọi n Al =a (mol) ; n Fe = b(mol) => 27a + 56b = 6 -1,86 = 4,14(1)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
n H2 = 1,5a + b = 3,024/22,4 = 0,135(2)
Từ (1)(2) suy ra a = 0,06 ; b = 0,045
Vậy :
%m Cu = 1,86/6 .100% = 31%
%m Al = 0,06.27/6 .100% = 27%
%m Fe = 100% -31% -27% = 42%
Đúng 1
Bình luận (0)
Khi hòa tan 6g hợp kim hỗn hợp gồm Cu, Fe, Al trong axit HCl dư thì tạo tành 3,024 lít khí H2 và còn lại 1,86 g kim loại không tan
a. viết phương trình hóa học xảy ra
b. tính thành phần % khối lượng của mỗi kim loại trog hh ban đầu
Các bạn giúp mình gấp nhé. gợi ý là giải hệ phương trình
a. Fe + 2HCl => FeCl2 + H2
2Al + 6HCl => 2AlCl3 + 3H2
b. mCu= m kim loại ko tan =1,86
=> mFe + m Al = 6-1,86 =4,14
giải hệ 56x + 27y = 4,14
x + 3y/2 = 0,135
=> x= 0,045 y= 0,06
=> mFe = 2,52 m Al = 1,62
=> %Fe = 42%
%Al= 27%
%Cu = 31%
Đúng 1
Bình luận (1)
Khi hoà tan 6 gam hợp kim gồm Cu, Fe và AI trong axit clohiđric dư thì tạo thành 3,024 lít H 2 (đktc) và còn lại 1,86 gam kim loại không tan. Viết các phương trình hoá học.
Fe + 2HCl → Fe Cl 2 + H 2
2Al + 6HCl → 2Al Cl 3 + 3 H 2
Đúng 0
Bình luận (0)
Hoà tan 6g hợp kim Cu,Fe,Al trong axit HCl dư thấy thoát ra 3,024 lít H2 và 1,86g chất rắn ko tan.thành phần phần trăm của hợp kim là
Rắn không tan là Cu
=> mCu = 1,86 (g)
Gọi số mol Fe, Al là a, b (mol)
=> 56a + 27b = 6 - 1,86 = 4,14 (1)
\(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
a--------------------->a
2Al + 6HCl --> 2AlCl3 + 3H2
b--------------------->1,5b
=> a + 1,5b = 0,135 (2)
(1)(2) => a = 0,045 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{1,86}{6}.100\%=31\%\\\%m_{Fe}=\dfrac{0,045.56}{6}.100\%=42\%\\\%m_{Al}=\dfrac{0,06.27}{6}.100\%=27\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Hòa tan 11g hỗn hợp bột Al và Fe vào dung dịch HCl (dư) thu được 8,96 lít H2 (đktc)a) Tính thành phần % theo khối lượng từng kim loại trong hỗn hợp đầub) Tính khối lượng muối tan thu đượcc) Nếu hòa tan hoàn toàn 2 kim loại trên bằng dung dịch axit H2SO4 đặc nóng thì thể tích khí SO2 thu được ở điều kiện tiêu chuẩn là bao nhiêu ?
Đọc tiếp
Hòa tan 11g hỗn hợp bột Al và Fe vào dung dịch HCl (dư) thu được 8,96 lít H2 (đktc)
a) Tính thành phần % theo khối lượng từng kim loại trong hỗn hợp đầu
b) Tính khối lượng muối tan thu được
c) Nếu hòa tan hoàn toàn 2 kim loại trên bằng dung dịch axit H2SO4 đặc nóng thì thể tích khí SO2 thu được ở điều kiện tiêu chuẩn là bao nhiêu ?
a) Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow27a+56b=11\) (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,4\cdot2=0,8\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2\cdot27}{11}\cdot100\%\approx49,09\%\\\%m_{Fe}=50,91\%\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{muối}=m_{AlCl_3}+m_{FeCl_2}=0,2\cdot133,5+0,1\cdot127=39,4\left(g\right)\)
c) Bảo toàn electron: \(3\cdot0,2+3\cdot0,1=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=0,45\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,45\cdot22,4=10,08\left(l\right)\)
Đúng 2
Bình luận (0)
a) Gọi nAl = x, nFe = y
Có 27x + 56y = 11 (1)
Bảo toàn e
3x + 2y = 2.0,4 (2)
Từ 1 và 2 => x = 0,2, y = 0,1
\(\%mAl=\dfrac{0,2.27}{11}.100\%=49,09\%\)
\(\%mFe=100-49,09=50,91\%\)
b) BTKL:
m muối = mkim loại + mHCl - mH2
= 11 + 0,4.2.36,5 - 0,4.2 = 39,4g
c)
Bảo toàn e
Al => Al+3 + 3e S+6 + 2e => S+4
0,2 0,6 2x x
Fe => Fe+3 + 3e
0,1 0,3
=> 2x = 0,6 + 0,3 => x = 0,45 mol
=> VSO2 = 0,45.22,4 = 10,08 lít
Đúng 1
Bình luận (0)
hòa tan 8,4 g hỗn hợp gồm Fe và kim loại M vào dung dịch HCl dư thì thu được 4,48 lít khí h2 .nếu hòa tan 2,75 gam kim loại M thì không dùng hết 9,125 gam axit HCl.
1.xác định kim loại M
2.tính thành phần trăm về khối lượng của mỗi kim loại trong hỗn hợp ban đầu
1) Cho 7,8 gam hỗn hợp kim loại Al và Mg tác dụng với HCl thu được 8,96 lít H2 (ở đktc). Hỏi khi cô cạn dung dịch thu được bao nhiêu gam muối khan ?
2) Hỗn hợp gồm Al, Mg, Cu nặng 20g được hòa tan bằng axit HCl dư thoát ra 17,92 lít khí (đktc) và nhận được dung dịch A cùng 4,4 gam chất rắn B
a) Viết pt.
b) Tính % khối lượng mỗi kim loại.
3) Khi hòa tan 6g hỗn hợp kim loại gồm Cu, Fe và Al trong axit HCl dư thì tạo thành 3,024 lít khí H2 ( đktc) vvà còn lại 1,86g kim loại không tan.
a) Viết...
Đọc tiếp
1) Cho 7,8 gam hỗn hợp kim loại Al và Mg tác dụng với HCl thu được 8,96 lít H2 (ở đktc). Hỏi khi cô cạn dung dịch thu được bao nhiêu gam muối khan ?
2) Hỗn hợp gồm Al, Mg, Cu nặng 20g được hòa tan bằng axit HCl dư thoát ra 17,92 lít khí (đktc) và nhận được dung dịch A cùng 4,4 gam chất rắn B
a) Viết pt.
b) Tính % khối lượng mỗi kim loại.
3) Khi hòa tan 6g hỗn hợp kim loại gồm Cu, Fe và Al trong axit HCl dư thì tạo thành 3,024 lít khí H2 ( đktc) vvà còn lại 1,86g kim loại không tan.
a) Viết pt phản ứng hóa học xảy ra.
b) Tính thành phần % khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Xem thêm câu trả lời
Cho 6 g hợp kim Cu, Fe và Al vào dung dịch axit HCl dư thấy thoát ra 3,024 lít H 2 (đktc) và 1,86 g chất rắn không tan. Thành phần phần trăm của hợp kim là
A. 40% Fe, 28% Al, 32% Cu
B. 41% Fe, 29% Al, 30% Cu
C. 42% Fe, 27% Al, 31% Cu
D. 43% Fe, 26% Al, 31% Cu