khử 14,4 g FeO bằng H2 sau phản ứng thu được 12,8 g chất rắn tính V H2 pu

Những câu hỏi liên quan
khử 14,4 g FeO bằng H2 sau phản ứng thu được 12,8 g chất rắn tính V H2 pu
FeO + H2 -> Fe + H2O (1)
Ta có:
mO bị khử + mchất rắn=mFeO
=>mO bị khử=14,4-12,6=1,8(g)
nO=0,1125(mol)
Từ 1:
nH2=nO=0,1125(mol)
VH2=22,4.0,1125=2,52(lít)
Đúng 0
Bình luận (1)
PTHH:
FeO + H2 \(\rightarrow\) Fe + H2O
Số mol FeO tham gia phản ứng là:
14,4 : 72 = 0,2 (mol)
Theo PTHH, số mol H2 tham gia phản ứng là 0,2 mol.
Thể tích H2 tham gia phản ứng là:
0,2 . 22,4 = 4,48 (l)
Đúng 0
Bình luận (1)
Ta có nFeO = 14,4/72 = 0,2 mol.
Xét 2 trường hợp:
1) FeO bị khử hoàn toàn (H2 vừa đủ).
PTHH: FeO + H2 -> Fe + H2O.
Theo PTHH => nFe = nFeO = 0,2 mol
=> mFe = 0,2.56 = 11.2 < 12.8 (vô lý)
=> Loại. Vậy FeO chưa bị khử hết (H2 thiếu)
Gọi nH2(phản ứng) = a mol.
PTHH: FeO + H2 -> Fe + H2O.
Theo phương trình
=> nFeO(phản ứng) = nFe = nH2 = a mol
=> nFeO(dư) = 0,2 -a (mol).
Ta có:
m(rắn) = mFeO(dư) + mFe
= (0,2 -a).72 + 56a = 12.8.
Giải phương trình => a = 0.1 => nH2 = 0.1 mol
=> VH2 = 0.1 *22.4 = 2.24 lít
Đúng 0
Bình luận (0)
Dùng khí 11,2 lít h2 để khử 31,2 g hỗn hợp gồm cuo , feo và fe2o3 . sau khi phản ứng kết thúc thu được m g chất rắn . Tính m
\(n_{H_2O}=n_{H_2}=n_O=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ m_{rắn}=m_{kl}=m_{oxit}-m_O=31,2-0,5.16=23,2\left(g\right)\)
Đúng 1
Bình luận (1)
để khử hoàn toàn toàn 47,2 gam hỗn hợp CuO, FeO, Fe3O4 cần dùng V lít khí H2(đktc). sau phản ứng thu được m gam kim loại và 14,4 gam nước . Tính m và V
n H2O=14,41814,418 =0,8 mol
⇒n H2=0,8 mol
n O=0,8 mol
⇒V H2(đktc)=0,8.22,4=17,92 l
theo đlbt khối lượng:
mkl+mO=m oxit
⇔mkl+0,8.16=47,2
⇔mkl=34,4 g
Đúng 7
Bình luận (0)
\(n_{H_2O}=n_{H_2}=n_{O\left(mất\right)}=\dfrac{14,4}{18}=0,8\left(mol\right)\\ \Rightarrow m=m_{kim.loại}=m_{hhoxit}-m_{O\left(mất\right)}=47,2-0,8.16=34,4\left(g\right)\\ V=V_{H_2\left(đktc\right)}=0,8.22,4=17,92\left(l\right)\)
Đúng 3
Bình luận (0)
Xem thêm câu trả lời
Sử dụng định luật BTKL, bảo toàn NT để tính Câu 1 : để khử hoàn toàn 30 g hỗn hợp gồm CuO , FeO,Fe3O4,Fe2O3 cần dùng 5, 6 lít khí CO ( đkc) . Tính khối lượng chất rắn thu đc sau phản ứng ( biết CO có tính khử giống H2) .Câu 2 :dẫn luồn khí H2 dư đi qua 16g hỗn hợp hai oxide CuO và Fe2O3 nung nóng . Sau phản ứng để nguội , cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxide trong hỗn hợp ban đầu .Câu 3 : Dãn luồng khí H2 dư đi qua hỗn hợp hai oxide CuO và Fe2O3 nung...
Đọc tiếp
Sử dụng định luật BTKL, bảo toàn NT để tính
Câu 1 : để khử hoàn toàn 30 g hỗn hợp gồm CuO , FeO,Fe3O4,Fe2O3 cần dùng 5, 6 lít khí CO ( đkc) . Tính khối lượng chất rắn thu đc sau phản ứng ( biết CO có tính khử giống H2) .
Câu 2 :dẫn luồn khí H2 dư đi qua 16g hỗn hợp hai oxide CuO và Fe2O3 nung nóng . Sau phản ứng để nguội , cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxide trong hỗn hợp ban đầu .
Câu 3 : Dãn luồng khí H2 dư đi qua hỗn hợp hai oxide CuO và Fe2O3 nung nóng . Sau phản ứng để nguội thu , cân lại thấy khối lượng hỗn hợp giảm 28,8%. Tính phần trăm khối lượng của mỗi oxide trong hỗn hợp ban đầu .
Câu 2:
Ta có: 80nCuO + 160nFe2O3 = 16 (1)
m giảm = 16.25% = 4 (g) = mO (trong oxit)
\(\Rightarrow n_{O\left(trongoxit\right)}=\dfrac{4}{16}=0,25\left(mol\right)\)
BTNT O, có: nCuO + 3nFe2O3 = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CuO}=0,1\left(mol\right)\\n_{Fe_2O_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1.80}{16}.100\%=50\%\\\%m_{Fe_2O_3}=50\%\end{matrix}\right.\)
Bạn bổ sung đủ đề câu 3 nhé.
Đúng 2
Bình luận (0)
Câu 1:
Ta có: \(n_{CO}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BTNT C, có: nCO2 = nCO = 0,25 (mol)
BTKL, có: mhh + mCO = m chất rắn + mCO2
⇒ m chất rắn = 30 + 0,25.28 - 0,25.44 = 26 (g)
Đúng 1
Bình luận (0)
Hỗn hợp A gồm FeO , CuO, và oxit kim loại R ( trong đó FeO chiếm 6,21% về khối lượng ) . Đem khử hoàn toàn 5,8 g hỗn hợp A bằng khí H2 dư sau phản ứng thu được hỗn hợp kim loại B và 1,71g H20 . Lấy toàn bộ lượng hh kim loại B đem hòa tan vào dd H2SO4 loãng thu được 1,456l khí H2 ở đktc và 0,64 g chất rắn không tan.
Cho luồng khí H2 đi qua 30 g FeO sau phản ứng thu được 16 gam chất rắn. Tính hiệu suất phản ứng.
\(FeO+H_2\rightarrow Fe+H_2O\)
5/12 _________5/12
\(n_{FeO}=\frac{30}{56+16}=\frac{5}{12}\)
\(m_{Fe}=\frac{5}{12}.56=\frac{70}{3}\)
\(\rightarrow H=\frac{16}{\frac{70}{3}}.100\%=68,57\%\)
Để khử hoàn toàn 53,2(g) hốn hợp chất rắn A gồm CuO, Fe2O3, Fe3O4, MgO cần dùng V(l) khí H2 ở điều kiện tiêu chuẩn. Sau phản ứng thu được m g chất rắn B và 14,4 g H2O. Tính giá trị của m và V.
Ai còn on giúp mik với, chiều nay mik phải nộp rùi. HELP MEEEEEEEEEEEEEEEEEEEE!!!!!!!!!!!!!!!!!!!!!!!!!!!!
nH2O = 0.8 mol
CuO + H2 -to-> Cu + H2O
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
Fe3O4 + 4H2 -to-> 3Fe + 4H2O
Từ PTHH :
nH2O = nH2 = 0.8 mol
=> V = 17.92 l
=> mH2 = 1.6 g
mCr = 53.2 + 1.6 - 14.4 = 40.4 g
Đúng 0
Bình luận (0)
nH2O = 14,4/18 = 0,8 mol
CuO + H2 --> Cu + H2O
Fe2O3 + 3H2 ---> 2Fe + 3H2O
Fe3O4 + 4H2 --> 3Fe +4H2O
nH2O = nH2 = 0,8 mol
VH2 = 0,8.22,4 = 17,92 l
m = 53,2 + 0,8.2 - 14,4 = 40,4 g
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Câu 3 :1. Để khử hoàn toàn 47,2 gam hỗn hợp CuO , FeO, Fe3O4 cần dùng V lít khí H2 (ở đktc). Sau phản ứng thu được m gam kim loại và 14,4 gam nước.a) Viết PTHH xảy ra?b) Tính giá trị m và V?2. Đốt cháy hoàn toàn 23 gam hợp chất A cần 33,6 lít ôxi (đktc) và thu được thể tích CO2 bằng 2/3 thể tích hơi nước . Xác định CTHH của A. Biết rằng tỉ khối hơi của A so với khí ôxi là 1,4375.
Đọc tiếp
Câu 3 :
1. Để khử hoàn toàn 47,2 gam hỗn hợp CuO , FeO, Fe3O4 cần dùng V lít khí H2 (ở đktc). Sau phản ứng thu được m gam kim loại và 14,4 gam nước.
a) Viết PTHH xảy ra?
b) Tính giá trị m và V?
2. Đốt cháy hoàn toàn 23 gam hợp chất A cần 33,6 lít ôxi (đktc) và thu được thể tích CO2 bằng 2/3 thể tích hơi nước . Xác định CTHH của A. Biết rằng tỉ khối hơi của A so với khí ôxi là 1,4375.
Khử 24 gam Fe2O3 bằng 6,72lít khí H2 (đktc)
a. Sau phản ứng chất nào hết, chất nào dư? Tính khối lượng chất dư?
b. Tính khối lượng Fe thu được sau phản ứng?
c. Tính khối lượng hỗn hợp rắn thu được sau phản ứng?
dễ mà
mình thử các bạn thôi chứ mình ko like đâu nhé ![]()
Đúng 0
Bình luận (0)
\(a.n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\\ n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ Fe_2O_3+3H_2\underrightarrow{to}2Fe+3H_2O\\ Vì:\dfrac{0,3}{3}< \dfrac{0,15}{1}\\ \rightarrow Fe_2O_3dư\\ n_{Fe_2O_3\left(dư\right)}=0,15-\dfrac{0,3}{3}=0,05\left(mol\right)\\ m_{Fe_2O_3\left(dư\right)}=0,05.160=8\left(g\right)\\ b.n_{Fe}=\dfrac{0,3}{3}.2=0,2\left(mol\right)\\ m_{Fe}=0,2.56=11,2\left(g\right)\\ c.m_{rắn}=m_{Fe}+m_{Fe_2O_3\left(dư\right)}=11,2+8=19,2\left(g\right)\)
Đúng 2
Bình luận (0)











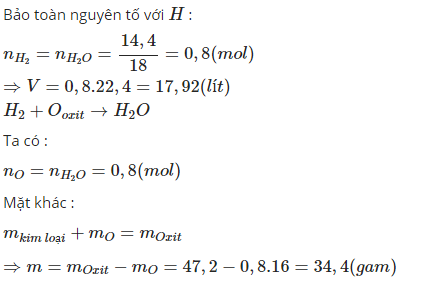








 âu
âu