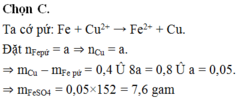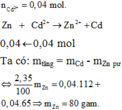Ngâm một lá kẽm khối lượng a gam vào 100ml duch dịch AgNO3 0,1M đến khi phản ứng xảy ra hoàn toàn , lấy lá kim loại ra rửa sạch , làm khô , cân lại thấy nặng 2,0 gam .Tính giá trị của a

Những câu hỏi liên quan
Ngâm một lá kẽm khối lượng a gam vào 100ml duch dịch AgNO3 0,1M đến khi phản ứng xảy ra hoàn toàn , lấy lá kim loại ra rửa sạch , làm khô , cân lại thấy nặng 2,0 gam .Tính giá trị của a
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là A. 3,2 gam B. 6,4 gam C. 7,6 gam D. 14,2 gam
Đọc tiếp
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là
A. 3,2 gam
B. 6,4 gam
C. 7,6 gam
D. 14,2 gam
Đáp án C
Ta cớ pứ: Fe + Cu2+ → Fe2+ + Cu.
Đặt nFepứ = a ⇒ nCu = a.
⇒ mCu – mFe pứ = 0,4 Û 8a = 0,8 Û a = 0,05.
⇒ mFeSO4 = 0,05×152 = 7,6 gam
Đúng 0
Bình luận (0)
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là
Đọc tiếp
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là
![]()
![]()
![]()
![]()
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe rửa sạch, sấy khô cân lại thấy nặng 100,4 gam, Giả sử toàn bộ kim loại sinh ra đều bám vào sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là: A. 3,2 gam . B. 6,4 gam. C. 7,6 gam D. 14,2 gam.
Đọc tiếp
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe rửa sạch, sấy khô cân lại thấy nặng 100,4 gam, Giả sử toàn bộ kim loại sinh ra đều bám vào sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là:
A. 3,2 gam .
B. 6,4 gam.
C. 7,6 gam
D. 14,2 gam.
Đáp án C
nCuSO4 = 0,2. 0,5 = 0,1 (mol) ; Gọi nFe phản ứng = x (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu ↓
Theo PTHH 56x 64x
Khối lượng kim loại tăng ∆ = (64x -56x)= 8x (g)
Theo đề bài ∆m tăng = ( 100,4 -100) = 0,4 (g)
=> 8x = 0,4
=> x = 0,05 (mol)
=> mFeSO4 = 0,05. 152 = 7,6 (g)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.a) Tính m và C.b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
Đọc tiếp
Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.
a) Tính m và C.
b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)
Đúng 0
Bình luận (0)
Ngâm một lá kẽm vào dung dịch có hoà tan 8,32 gam CdSO4. Phản ứng xong lấy lá kẽm ra khỏi dung dịch, rửa nhẹ, làm khô thì thấy khối lượng lá kẽm tăng thêm 2,35% so với khối lượng lá kẽm trước phản ứng. Khối lượng lá kẽm trước phản ứng là: A. 80 gam. B. 60 gam C. 20 gam D. 40 gam
Đọc tiếp
Ngâm một lá kẽm vào dung dịch có hoà tan 8,32 gam CdSO4. Phản ứng xong lấy lá kẽm ra khỏi dung dịch, rửa nhẹ, làm khô thì thấy khối lượng lá kẽm tăng thêm 2,35% so với khối lượng lá kẽm trước phản ứng. Khối lượng lá kẽm trước phản ứng là:
A. 80 gam.
B. 60 gam
C. 20 gam
D. 40 gam
Ngâm 1 lá kẽm khối lượng a gam vào 100 ml dd AgNO3 0,1 M đến khi phản ứng xảy ra hoàn toàn , lấy lá kim loại ra rửa sạch , làm khô , cân lại thấy nặng 2,0 gam Tính giá trị của a ?
Pư xảy ra hoàn toàn nhưng tôi ko biết chất nào dư, chất nào hết nên giả thiết có 2 trường hợp:
TH1: Zn dư, AgNO3 hết
Đặt x là số mol của Zn pư:
PTHH: Zn + 2AgNO3 -----> Zn(NO3)2 + 2Ag
x.............2x.........................................2x
Ta có: mZndư + mAg= (a - 65x) +2.108x = a + 151x = 2(*)
nAgNO3 = 0.1*0.1=0.01 mol
Theo PTHH, nZnpư = 1/2nAgNO3 = 0.005 mol
=>mZnpư = 0.005*65=0.325(**)
Thay(**) vào (*) => a=1.245g
TH2: AgNO3 dư, Zn hết
PTHH: Zn +2AgNO3 -----> Zn(NO3)2 + 2Ag
\(\dfrac{a}{65}\) ........\(\dfrac{2a}{65}\) ...................................\(\dfrac{2a}{65}\)
nAgNO3= 0.1*0.1=0.01 mol
Vì nAgNO3pư < nAgNO3ban đầu => \(\dfrac{2a}{65}\) < 0.01
giải ra a < 0.325g(***)
Thay nZnpư vào (*) => a \(\approx\) 0.6g > 0.325g (loại)
Vậy a= 1.245g
Đúng 0
Bình luận (0)
Ngâm một lá sắt có khối lượng 50 gam trong 200 gam dung dịch muối sunfat của kim loại m hóa trị 2 nồng độ 16% sau khi toàn bộ mùa xuân Pháp đã phản ứng hết lấy lá sắt ra rửa nhẹ làm khô căng lại thấy khối lượng tăng 3,2% so với ban đầu. Xác định công thức hóa học muối sunfat của kim loại m
Bạn tham khảo nhá!!!
mCuSO4 = = = 32 (gam)
nCuSO4 = = 0,2 (mol)
Gọi x là khối lượng miếng sắt ban đầu.
Khối lượng miếng sắt sau khi nhúng vào dung dịch CuSO4 tăng là:
= 0,08.x (gam)
Fe + CuSO4 ---> FeSO4 + Cu
1mol 1mol 1mol 1mol
0,2mol 0,2mol 0,2mol 0,2mol
Khối lượng sắt phản ứng: 0,2.56 = 11,2 (gam)
Khối lượng Cu sinh ra: 0,2.64 = 12,8 (gam)
Khối lượng miếng sắt tăng lên = mCu sinh ra - mFe phản ứng
=> 0,08.x = 12,8 – 11,2
0,08.x = 1,6 => x = 20 (gam)
Vậy khối lượng miếng sắt ban đầu là 20 gam
Đúng 0
Bình luận (1)
Cho lá kẽm có khối lượng 25 gam vào dung dịch đồng sunfat. Sau khi phản ứng kết thúc, đem tấm kim loại ra rửa nhẹ, làm khô cân được 24,96 gam. Tính khối lượng kẽm đã phản ứng.
Dạng bài toán cho kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của chúng có hai trường hợp sau
+ Nếu đề bài cho khối lượng thanh kim loại tăng, lập phương trình đại số :
m kim loại giải phóng - m kim loại tan = m kim loại tăng
+ Nếu đề bài cho khối lượng thanh kim loại giảm, lập phương trình đại số :
m kim loại tan - m kim loại giải phóng = m kim loại giảm
Gọi x là số mol Zn tham gia
65x - 64x = 25 - 24,96 => x = 0,04 mol
m Zn p / u = 0,04 x 65 = 2,6 g
Đúng 0
Bình luận (0)