hòa tan 11.7 g kim loại A hóa trị I vào 120 ,6 g tì thu đc 132 (g) dung dịch A
a)Xác định kim loại A
b)Tính C% dung dịch B
c) Cho toàn bộ dung dịch A vào dumg dịch cóc hứa nước 16.3 (g) ZnCl\(_2\) thì có a(g) kết tủa xuất hiện .Tính A
Giai: 2M + 2xH2O → 2M(OH)x + xH2
amol a mol 0,5xa mol
Theo bài ra ta có: mkim loại = Ma = 4 gam (*)
=>mdd = Ma + 96,2 – 2.0,5xa = 4 + 96,2 – xa = 100,2 – xa
Khối lượng M(OH)x = (M+17x)a = Ma + 17xa = 4 + 17xa
=>C% của M(OH)x = 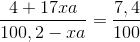
=>400 +1700xa = 741,48 – 7,4xa =>xa = 0,2 (**)
Từ (*) và (**): 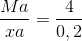
=>M = 20x
Lập bảng:
x 1 2 3
M 20 40 60
Kết luận / Ca /=>M là Ca(canxi)
Hòa tan hoàn toàn 2,3 g một kim loại nhóm 1A vào 57,8 g nước thu được 1,12 lít khí h2 và dung dịch a
a. xác định tên kim loại
b .tính nồng độ phần trăm chất tan trong dung dịch a
a)Gọi A là kim loại cần tìm.
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
Ta có PTHH:
\(2A+2H_2O\rightarrow2AOH+H_2\uparrow\)
0,1-----------------0,1--------0,05-----(mol);
Vậy \(M_A=\dfrac{2,3}{0,1}=23\)(g/mol) => A là Na
b) Ta có: \(m_{dd}=2,3+57,8-0,05\cdot2=60g\)
Từ đó suy ra:\(\%C_{NaOH}=\dfrac{0,1\cdot40}{60}\cdot100\%=6,67\%\)
8, đốt cháy hoàn toàn 41,1 g Kim loại A ( hóa trị 2) bằng lượng khí Clo vừa đủ , hòa tan sp vào nước thu được dung dịch B ,cho dung dịch B phản ứng với dung dịch agno3 dư , thấy có 86,1 g kết tủa trắng xuất hiện a, viết PTHH b, tìm A c, tính V Clo đktc D, tìm m muối tạo thành
Hòa tan hết 2,019g hỗn hợp gồm muối clorua của kim loại A chỉ có hóa trị 1, muối clorua cảu kim loại B chỉ cso hóa trị 2 trong mọi hợp chất vào nước được dung dịch X. cho 50ml dung dịch AgNO3 1M vào dung dịch X, sau khi xảy ra phản ứng hoàn toàn thu được 5,74g kết tủa. lọc kết tủa, cô cạn dung dịch nước lọc thu được a g muối khan,
a/ Tìm a
b/ xác định KL A,B biết rằng MB=MA+1
A là oxit của một kim loại R hóa trị II. Hòa tan 5,6 (g) A trong dung dịch HCl 7,3% vừa đủ thu được dung dịch có chứa 11,1 (g) muối B. Xác định công thức của A và tính C% muối B trong dung dịch thu được
vì a là oxit của kloaij R nên a có dạng RO
RO + 2HCL-> RCL2+ H2O
5,6/(R+16)-> 5,6/(R+16)
5,6/(R+16)= 11,1/(R+71)
=> R=40
công thức của a là cao
nhcl= 2ncao=2*( 5,6/56)=0,2
mddsau pư= 5,6+0,2*36,5*100/7,3-0,1*2=105,4
C% cacl2=11,1/105,4*100=10,53
Hòa tan hoàn toàn a (g) oxit của một Kim loại hóa trị II trong 48g dung dịch H2SO4 lít, nồng độ 6,125% thu được dung dịch chất tan trong đó H2SO4 có nồng độ 0,98%. Mặt khác dùng 2,8 lít CO để khử a (g) oxit trên thành kim loại thu được khí B duy nhất. Nếu lấy 0,896 lít khí B cho vào dung dịch Ca(OH)2 dư thu được 0,8 g kết tủa. tìm giá trị của a và xác định công thức của oxit kim loại đó . Biết các thể tích khí đó cùng đktc
Hòa tan 7,2 g kim loại M có hóa trị II vào dung dịch HCl 1M thì thu được 28,5 g muối khan.
a. Xác định kim loại M.
b. Tính thể tích dung dịch HCl cần dung
a) \(n_M=\dfrac{7,2}{M_M}\left(mol\right)\)
PTHH: M + 2HCl --> MCl2 + H2
_____\(\dfrac{7,2}{M_M}\)--------->\(\dfrac{7,2}{M_M}\)
=> \(\dfrac{7,2}{M_M}\left(M_M+71\right)=28,5=>M_M=24\left(Mg\right)\)
b)
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
_____0,3---->0,6
=> \(V_{dd}=\dfrac{0,6}{1}=0,6\left(l\right)\)
Gọi A là kim loại M
\(A+2HCl\rightarrow MCl_2+H_2\uparrow\)
\(\dfrac{7.2}{A}=\dfrac{28.5}{A+71}\) (Mol)
=> 7.2(A+71)=28.5A
(=)7.2A+511.2=28.5A
(=) 7.2A-28.5A=-511.2
(=)-21.3A=-511.2
(=)A=\(\dfrac{-511.2}{-21.3}\)
(=)A=24
hay A=M= Mg
b) Theo pt trên
nHCl=2nMg(=)nHCl=2x\(\dfrac{7.2}{24}\)=0.6 (mol)
VHCl =\(CM=\dfrac{n_{HCl}}{V_{HCl}}\left(=\right)V=\dfrac{n}{CM}=\dfrac{0.6}{1}=0.6\left(l\right)\)
Cho 12,8 gam kim loại A hóa trị II phản ứng hoàn toàn với khí Cl2 thu muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh sắt nặng 11,2 gam vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh sắt và khối lượng thanh sắt là 12,0 gam, nồng độ FeCl2 trong dung dịch là 0,25M. Xác định kim loại A và nồng độ mol của kim loại B trong dung dịch C.
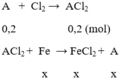
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 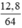 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 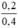 = 0,5M
= 0,5M
a, Hòa tan hoàn toàn 3,6g một kim loại A hóa trị II bằng dung dịch axit clohidric (HCl) thu được 3,36 l khí hiđro (đktc). Xác định tên kim loại A?
b, Nếu cho lượng kim loại A nói trên vào 14,6 g axit clohidric, tính khối lượng các chất thu được sau khi phản ứng kết thúc?
\(a,A+2HCl\rightarrow ACl_2+H_2\\ n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_A=n_{H_2}=0,15\left(mol\right)\\ \Rightarrow M_A=\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\\ \Rightarrow A\left(II\right):Magie\left(Mg=24\right)\\ b,Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{H_2}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\\ Vì:\dfrac{0,15}{1}< \dfrac{0,4}{2}\Rightarrow HCldư\\ \Rightarrow Sau.p.ứ:MgCl_2,HCldư\\ n_{MgCl_2}=n_{Mg}=0,15\left(mol\right)\\ \Rightarrow m_{MgCl_2}=95.0,15=14,25\left(g\right)\\ n_{HCl\left(dư\right)}=0,4-0,15.2=0,1\left(mol\right)\\ \Rightarrow m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\\ m_{chất.sau}=3,65+14,25=17,9\left(g\right)\)