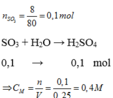cho 1 dd axit sunfuric trong đó số mol H2SO4 =sỐ mol H2O .tính nồng độ %

Những câu hỏi liên quan
Có 1 đ axit sunfuric, trong đó số mol H2SO4 bằng số mol H2O. Tính C% của H2SO4
Giả sử số mol đều là x mol
=> mH2SO4=98x
mH2O=18x
C%H2SO4=\(\dfrac{98x}{98x+18x}.100=84,48\%\)
Đúng 2
Bình luận (2)
Cho 5,4g nhôm tác dụng với dd chứa axit sunfuric H2SO4 có nồng độ 2M.
a) Tính thể tích dd axit sunfuric H2SO4 tham gia phản ứng ? Sau đó tính nồng độ mol đ tạo thành sau phản ứng. Biết rằng sau phản ứng thể tích thay đổi không đáng kể.
b) Thể tích khí hidro thu được ở đktc?
a)
$n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH:
$n_{H_2SO_4} = n_{H_2} = \dfrac{3}{2}n_{Al} = 0,3(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,3}{2} = 0,15(lít)$
$n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al} = 0,1(mol)$
$C_{M_{Al_2(SO_4)_3}} = \dfrac{0,1}{0,15} = 0,67M$
b)
$V_{H_2} = 0,3.22,4 = 6,72(lít)$
Đúng 2
Bình luận (1)
1 Tính số mol của H2SO4 trong 100 ml dd H2SO4 49% .
Sau đó tính nồng độ mol của H2SO4
2 Tính nồng độ mol của các dd sau
a 3,65g HCl trong 200 ml dd
b 0.2 mol H2SO4 trong 100 dd
1 thiếu m dd H2SO4 hoặc D nhé
2
\(a\) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5M\)
\(b\) \(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
Đúng 1
Bình luận (1)
Cho một lượng bột sắt dư vào 50ml dd axit sunfuric. Phản ứng xong thu được 3,36 lít khí H2 (đkc).
a. Tính khối lượng sắt đã tham gia phản ứng.
b. Tính nồng độ mol của dd axit sunfuric đã dùng.
c. Tính nồng độ mol của dd thu được sau phản ứng (thể tích dd thay đổi không đáng kể)
a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b)
$n_{H_2SO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{H_2SO_4}} = \dfrac{0,15}{0,05} = 3M$
c)
$n_{FeSO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,15}{0,05} = 3M$
Đúng 1
Bình luận (1)
Cho 1,12g Fe vào 200ml dd axit sunfuric loãng, nồng độ 0,12M.
a, Vt pthh.
b, Tính nồng độ mol của các chất trong dd sau phản ứng (coi thể tích dd không đổi).
a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, \(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\)
\(n_{H_2SO_4}=0,2.0,12=0,024\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,02}{1}< \dfrac{0,024}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{FeSO_4}=n_{Fe}=0,02\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,024-0,02=0,004\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{FeSO_4}}=\dfrac{0,02}{0,2}=0,1\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,004}{0,2}=0,02\left(M\right)\end{matrix}\right.\)
Đúng 3
Bình luận (1)
\(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\)
\(n_{H_2SO_4}=0,12.0,2=0,024\left(mol\right)\)
\(a,PTHH:\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Trc p/u: 0,02 0,024
p/u: 0,02 0,02 0,02 0,02
sau : 0 0,004 0,02 0,02
-> sau pư H2SO4 dư
\(m_{FeSO_4}=0,02.3,04\left(g\right)\)
\(m_{ddFeSO_4}=1,12+\left(0,024.98\right)-\left(0,02.2\right)=3,432\left(g\right)\)
\(C\%_{FeSO_4}=\dfrac{3,04}{3,432}.100\%\approx88,58\%\%0\)
\(C\%_{H_2SO_4dư}=\dfrac{0,004.98}{0,024.98}.100\%\approx16,67\%\)
Đúng 0
Bình luận (1)
Cho 8 gam lưu huỳnh trioxit (
S
O
3
) tác dụng với
H
2
O
, thu được 250 ml dung dịch axit sunfuric (
H
2
S
O
4
). Nồng độ mol của dung dịch axit thu được là A. 0,1M B. 0,4M C. 0,5M D. 0,6M
Đọc tiếp
Cho 8 gam lưu huỳnh trioxit ( S O 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 S O 4 ). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M
Cho 8 gam lưu huỳnh trioxit ( SO 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 SO 4 ).
Xác định nồng độ mol của dung dịch axit thu được.
Nồng độ mol của dung dịch H 2 SO 4 :
n H 2 SO 4 = n SO 3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
C Mdd H 2 SO 4 = 1000x0,1/250 = 0,4M
Đúng 0
Bình luận (0)
Tính nồng độ mol của dd axit sunfuric nồng độ 19,6% có KL riêng d = 1,25g/ml
Đổi d=1.25g/ml=1250g/l
-->CM=\(\dfrac{19,6\%.1250}{98}\)=2,5M
Đúng 0
Bình luận (0)
1/Dung dịch axit CH3CooH 2.03M có D=1.017g/ml.Tính nồng đọ molan của dung dịch ?
2/dd axit sunfuric 27% có D=1.198. tính nồng độ mol/l và nồng độ molan của dd ?