Cho 48,67g dd HCl 30% vài bình chưa 53,2g một kim loại kiềm. cho bay hơi dd trong đk k có ko khí thì thu đc 99,92g chất rắn là hỗn hợp 2 hoặc 3 chất. Xđ kim loại kiềm

Những câu hỏi liên quan
Cho 43,09g dd HCL 29,78% vào bình chứa 53,2g 1 kim loại kiềm. Cho bay hơi dd thu đc bã rắn, tìm kim loại trong các trường hợp sau
a. Bã rắn gồm 1 chất , có m=67,4g
b.Bã rắn có 2 chất, có m=99,92g
c.Bã rắn có 3 chất, có m=99,92g
đề:Cho 49,03 gam DD HCL 29,78 % vào 1 bình chứa 53.2 gam 1 kl kiềm. Cho bay hơi DD thu được trong đk không có khô?
ng có không khí thì thu ddc m gam bã rắn. Hãy xác định kl kiềm nếu:
A> + m = 67.4 g chỉ chứa 1 hợp chất
B> + m = 99.92g là hỗn hợp của 2 hoặc 3 chất
giải:
kim loại kiềm có hóa trị I, kim loại kiềm thổ hóa trị II
Ta có: C%HCl = m chất tan / m dung dịch . 100%
<-> 29.78% = m chất tan / 49.03 . 100%
-> m chất tan HCl = 14.6
-> nHCl = 14.6 / 36.5 = 0.4 mol
Đặt kim loại kiềm là W.
W tác dụng với HCl trước, tác dụng với H2O trong dung dịch sau:
W + HCl -> WCl + 1/2H2↑-------------(1)
W + H2O -> WOH + 1/2H2↑----------------(2)
a) Chứa một hợp chất duy nhất chính là WCl
-> Phản ứng vừa đủ nên nHCl = nW = 0.4 mol
-> MW = 53.2 / 0.4 = 133 g
-> W là Cessi (Cs)
B1) m = 99.92 là hỗn hợp của 2 chất
-> m chứa WCl và WOH (trong đó 0.4 mol HCl phản ứng hết)
Lượng OH- trong chất rắn = 99.92 - mW - m[Cl-]
<-> = 99.92 - 53.2 - (0.4 . 35.5) [0.4 là số mol HCl = số mol Cl-]
<-> = 32.52g
nOH- = 32.52 / 17 = 1.913 mol
(1), (2)-> nW = nOH- + nHCl = 1.913 + 0.4 = 2.313 mol
-> W = 53.2 / 2.313 = 23 g
-> W là Natri (Na)
B2) m = 99.92 là hỗn hợp 3 chất:
-> m chứa WCl, WOH, W dư (bởi HCl đun lên phải bay hơi)
Từ câu b -> nW > 2.313 mol
-> W < 23
-> W là Liti (Li)
# bài tương tự bạn tham khảo nha#
Đúng 0
Bình luận (0)
Nung 16,2g hỗn hợp A gồm các oxit MgO,Al2O3 và MO trong một ống sứ rồi cho luồng khí H2 Đi qua. Ở điều kiện thí nghiệm H2 chỉ khử MO với hiệu suất 80%. Lượng hơi nước tạo ra chỉ đc hấp thụ 90% vào 15,3g dd H2SO4 90%,kết tủa thu đc dd H2SO4 86,34%. Chất rắn còn lại trong ống đc hòa tân trong một lượng vừa đủ axit HCl, thu đc dd B và còn lại 2,56g chất rắn kim loại M ko tan Lấy 1/10 dd B cho tác dụng với dd NaOH dư, lọc lấy kết tủa nung ở nhiệt đọ cao đến khối lượng ko đổi thì thu đc 0,28g...
Đọc tiếp
Nung 16,2g hỗn hợp A gồm các oxit MgO,Al2O3 và MO trong một ống sứ rồi cho luồng khí H2 Đi qua. Ở điều kiện thí nghiệm H2 chỉ khử MO với hiệu suất 80%. Lượng hơi nước tạo ra chỉ đc hấp thụ 90% vào 15,3g dd H2SO4 90%,kết tủa thu đc dd H2SO4 86,34%.
Chất rắn còn lại trong ống đc hòa tân trong một lượng vừa đủ axit HCl, thu đc dd B và còn lại 2,56g chất rắn kim loại M ko tan
Lấy 1/10 dd B cho tác dụng với dd NaOH dư, lọc lấy kết tủa nung ở nhiệt đọ cao đến khối lượng ko đổi thì thu đc 0,28g oxit
1) XĐ kim loại M
2) Tính % theo khối lượng các chất trong hỗn hợp A
a./ Khối lượng H2SO4: m(H2SO4) = 15,3.90% = 13,77g
Khối lượng dd axit sau khi hấp thụ H2O: m(dd sau) = 13,77/86,34% gam
Khối lượng H2O bị hấp thụ: m(H2O ht) = m(dd sau) - m(dd đầu) = 13,77/86,34% - 15,3
Khối lượng H2O tạo ra từ phản ứng khử MO:
m(H2O) = m(H2O ht)/90% = [13,77/86,34% - 15,3]/90% = 0,72g
→ n(H2O) = 0,72/18 = 0,04mol
H2 + MO → M + H2O
___________0,04__0,04
M = 2,56/0,04 = 64
→ kim loại M cần tìm là Cu
b./ Gọi x, y là số mol của MgO và Al2O3 có trong hh A
Số mol CuO có trong hh A: n(CuO) = 0,04/80% = 0,05mol
m(hh A) = m(MgO) + m(Al2O3) + m(CuO) = 40x + 102y + 0,05.80 = 16,2g
Số mol CuO có trong hh chất rắn sau pư với H2: n(CuO sau) = 0,05-0,04 = 0,01mol
Cho hh chất rắn tác dụng với HCl
MgO + 2HCl → MgCl2 + 2H2O
x______________x
Al2O3 + 6HCl → 2AlCl3 + 3H2O
y_______________2y
CuO + 2HCl → CuCl2 + 2H2O
0,01__________0,01
Lấy 1/20 dung dịch B tác dụng với NaOH dư
AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
x/10______________x/10
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
0,001_____________0,001
Nung kết tủa đến khối lượng không đổi
Mg(OH)2 → MgO + H2O
x/10_______x/10
Cu(OH)2 → CuO + H2O
0,001_____0,001
m(oxit) = m(MgO) + m(CuO) = 40.x/10 + 0,001.80 = 0,28g
→ x = 0,05mol → y = (16,2 - 0,05.40 - 0,05.80)/102 = 0,1mol
Khối lượng mỗi oxit trong A
m(MgO) = 0,05.40 = 2g; m(Al2O3) = 0,1.102 = 10,2g; m(CuO) = 0,05.80 = 4g
Phần trăm khối lượng mỗi oxit
%MgO = 2/16,2 .100% = 12,36%
%Al2O3 = 10,2/16,2 .100% = 62,96%
%CuO = 4/16,2 .100% = 24,68%
Đúng 0
Bình luận (0)
Câu b của bạn Hậu Duệ Mặt Trời chép mạng và nó sai hoàn toàn.
Đúng 0
Bình luận (0)
Cho 8,5 g hỗn hợp 2 kim loại kiềm thuộc 2 chu kì kế tiếp nhau vào 1 lít dd HCl 0.2M thu đc dd có ph=13 . Vậy 2 kim loại kiềm là
pH = 13 chứng tỏ dd sau phản ứng là dd kiềm, như vậy HCl đã hết và kim loại còn dư tiếp tục phản ứng với nước để tạo thành dd kiềm:
Gọi M là kim loại trung bình của 2 kim loại kiềm:
M + HCl ---> MCl + 1/2H2
M + H2O ---> MOH + 1/2H2.
pH = 13 ---> pOH = 1 ---> [OH] = 0,1 ---> nOH = nMOH = 0,1 mol.
Do đó nM = 0,2 + 0,1 = 0,3 mol. ---> M = 8,5/0,3 = 28,33 ---> 2 kim loại đó là: Na (23) và K (39).
Đúng 0
Bình luận (0)
Cho 8,15g hỗn hợp 2 kim loại kiềm thổ kế tiếp tác dụng với dd HCl 10% vừa đủ thu được dung dịch X và 5,6 lít khí ở đktc. Tìm tên hai kim loại và tính C% các chất trong dd X
Gọi kim loại kiềm thổ chung là R.
\(R+2HCl\rightarrow RCl_2+H_2\)
0,25 0,25
\(\Rightarrow M_R=\dfrac{8,15}{0,25}=32,6\)
\(\Rightarrow R_1< 32,6< R_2\)
Mà hai kim loại nằm ở 2 chu kì liên tiếp nên:
\(\left\{{}\begin{matrix}R_1:24\left(Mg\right)\\R_2:40\left(Ca\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Đốt 40,6g hỗn hợp kim loại gồm Al và Zn trong bình đựng khí Clo dư. Sau một thời gian ngừng pứ thu đc 65,45g hỗn hợp gồm 4 chất rắn. Cho hỗn hợp rắn này tan hết vào dd HCl thì đc V(lít) H2(đktc). Dẫn V(lít) khí này đi qua ống đựng 80g CuO nung nóng. Sau 1 thời gian thấy trong ống còn lại 72,32g chất rắn và chỉ có 80% H2 đã pứ. Xác định % khối lượng các kim loại trong hh kim loại Al-Zn
1./ Dẫn luồng khí H2 qua ống đựng CuO:
CuO + H2 → Cu + H2O
a a a
Khối lượng chất rắn giảm:
Δm = m(CuO pư) - m(Cu) = 80a - 64a = 80 - 72,32 = 7,68g
⇒ a = 7,68/16 = 0,48g
Số mol H2 tham gia pư: n(H2) = 0,48/80% = 0,6mol
Theo ĐL bảo toàn nguyên tố, số mol HCl tham gia pư là: n(HCl pư) = 2.n(H2) = 1,2mol
Theo ĐL bảo toàn khối lượng:
m(hh rắn) + m(HCl pư) = m(muối) + m(H2) ⇒ m(muối) = m(hh rắn) + m(HCl pư) - m(H2)
⇒ m(muối) = 65,45 + 0,12.36,5 - 0,6.2 = 108,05g
Gọi x, y là số mol Al và Zn có trong hh KL ban đầu.
m(hh KL) = m(Al) + m(Zn) = 27x + 65y = 40,6g
m(muối) = m(AlCl3) + m(ZnCl2) = 133,5x + 136y = 108,05g
⇒ x = 0,3mol và y = 0,5mol
Khối lượng mỗi kim loại:
m(Al) = 0,3.27 = 8,1g; m(Zn) = 65.0,5 = 32,5g
Thành phần % khối lượng mỗi kim loại:
%Al = 8,1/40,6 .100% = 19,95%
%Zn = 32,5/40,6 .100% = 80,05%
Đúng 1
Bình luận (1)
Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là: A. Natri , magie B. Liti và beri C. Liti và beri D. Kali , bari
Đọc tiếp
Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là:
A. Natri , magie
B. Liti và beri
C. Liti và beri
D. Kali , bari
Đáp án A
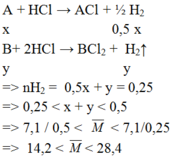
Chỉ có cặp nghiệm A = 23 (Na ) , B = 24 (Mg) thỏa mãn
Đúng 0
Bình luận (0)
Đốt một kim loại kiềm (hóa trị II) trong không khí, sau một thời gian đc chất rắn A. Hòa tan chất rắn A trong nc đc dd B và mkhis D ko màu và cháy đc trong không khí. Thổi khí CO2 vào dd B thu đc kết tủa Y. Cho kết tủa Y tác dụng với dd HCl ta thu đc khí CO2 và dd E, cho dd AgNO3 vào dd E thấy xuất hiện kết tủa màu trắng. Lọc bỏ kết tủa rồi cho dd H2SO4 vào nước lọc lại xuất hiện kết tủa trắng tiếp.Viết pt pứ xảy ra
Đọc tiếp
Đốt một kim loại kiềm (hóa trị II) trong không khí, sau một thời gian đc chất rắn A. Hòa tan chất rắn A trong nc đc dd B và mkhis D ko màu và cháy đc trong không khí. Thổi khí CO2 vào dd B thu đc kết tủa Y. Cho kết tủa Y tác dụng với dd HCl ta thu đc khí CO2 và dd E, cho dd AgNO3 vào dd E thấy xuất hiện kết tủa màu trắng. Lọc bỏ kết tủa rồi cho dd H2SO4 vào nước lọc lại xuất hiện kết tủa trắng tiếp.
Viết pt pứ xảy ra
Gọi kim loại kiềm đó là M
Khi đốt kim loại kiềm trong kk ta có f. ứ
M+ O2= MO
=>CR A thu được là MO và M dư
Khi cho CR A vào nước ta có f.ứ
M+ H2O= M(OH)2 + H2
MO+ H2O= M(OH)2
=>Dung dịch B là M(OH)2, khí D là CO2
Khi thổi khi CO2 vào dd B ta có f.ứ
CO2+ M(OH)2= MCO3 +H2O
=> Kết tủa Y là MCO3
Khi cho kết tủa Y td dd HCl ta có p.ứ
MCO3 + HCl= MCl2 + CO2+ H2O
=> Dd E là MCl2
Khi cho dd AgNO3 vào dd E ta có p.ứ
AgNO3 + MCl2 = AgCl+ MCO3
=> Lọc kết tủa đc dd AgNO3
AgNO3 + H2SO4 = Ag2SO4+ HNO3
Thử tham khảo nha, k chắc đúng đâu
Đúng 1
Bình luận (2)
Cho 3 gam hỗn hợp kim loại Na và một kim loại kiềm X tác dụng hết với H2O thu được dd A. để trung hòa dd A phải dùng dung dịch chưa 200 ml dd HCl 1M
a. Xác định kim loại kiềm X.
b. Tính khối lượng mỗi kim loại trong hỗn hợp.
Cho 4,4 gam hỗn hợp gồm hai kim loại kiềm thổ vào dd HCl dư được 3,36 lit Hy(đktc). Cô cạn dd thu được sau pứ sẽ thu được bao nhiêu gam chất rắn?
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,3\left(mol\right)\)
BTNT Cl, có: nCl (trong muối) = nHCl = 0,3 (mol)
Có: m muối = mKL + mCl = 4,4 + 0,3.35,5 = 15,05 (g)
Đúng 2
Bình luận (0)


























