cho bột sắt vào dd chứa 0,2 mol H2SO4 loãng phản ứng hoàn toàn ng ta thu được 1,68 lít khí H2 tính khối lượng sắt phản ứng và để có sắt trên ng ta phải dùng bao nhiêu gam sắt (III) oxit tác dụng với khí H2 dư
cho bột sắt vào đ chứa 0,2 mol H2SO4 loãng. phản ứng hoàn toàn, người ta thu được 1,68 lít khí H2.tính khối lượng sắt phản ứng và để FE trên ng ta phải dùng bao nhiêu g sắt (III) oxit tác dụng với khí H2 dư
giúp tôi![]() giải dễ hiểu tí
giải dễ hiểu tí
Cho mạt sắt vào một dung dịch chứa 0,2 mol H 2 S O 4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và người ta thu được 1,68 lit khí hidro (đktc). Để có lượng sắt tham gia phản ứng trên, người ta phải dùng bao nhiêu gam sắt (III) oxit tác dụng với khí hidro.
Bài 2: Cho sắt vào một dung dịch chứa 0,2 mol H2SO4 . Sau phản ứng
người ta thu được 1,68 (l) khí hiđro (đktc).
a) Viết phương trình phản ứng.
b) Tính khối lượng sắt phản ứng.
c) Để có lượng sắt phản ứng trên người ta phải dùng bao nhiêu
gam sắt (III) oxit tác dụng với khí hiđro dư.
\(a.n_{H_2SO_4}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,2}{1}>\dfrac{0,075}{1}\\ \Rightarrow H_2SO_4dư\\ b.n_{Fe}=n_{H_2}=0,075\left(mol\right)\\ m_{Fe}=56.0,075=4,2\left(g\right)\\ c.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ 0,025........0,075.......0,05.......0,075\left(mol\right)\\ m_{Fe_2O_3}=0,025.160=4\left(g\right)\)
Cho mạt sắt vào một dung dịch chứa 0,2 mol H 2 S O 4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và người ta thu được 1,68 lit khí hidro (đktc). Tính khối lượng mạt sắt đã phản ứng.
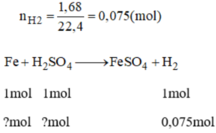
Theo phương trình phản ứng ta có:
n F e = n H 2 = 0,075 mol
n H 2 S O 4 = 0,075 mol (mà H 2 S O 4 đề cho là 0,2 mol nên H 2 S O 4 dư)
![]()
Cho mạt sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và,người ta thu được 1,68 lít khí hiđro (đktc).
a) Viết phương trình hoá học.
b) Tính khối lượng mạt sắt đã phản ứng.
c) tính khối lượng axit sunfuric còn dư trong dung dịch sau phản ứng
a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,075\left(mol\right)\Rightarrow m_{Fe}=0,075.56=4,2\left(g\right)\)
c, \(n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,075\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,075=0,125\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,125.98=12,25\left(g\right)\)
Bài 1: Cho kim loại sắt vào dung dịch axit H2SO4 loãng. Sau một thời gian, sắt tan hết thu được 6,72 lit khí hiđrô (đktc).
a) Tính khối lượng sắt ban đầu?
b) Để có lượng sắt tham gia phản ứng trên, phải cho bao nhiêu gam sắt(III) oxit tác dụng với khí hiđrô?
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3
a)\(m_{Fe}=0,3\cdot56=16,8g\)
b)\(Fe_2O_3+3H_2\rightarrow3Fe+3H_2O\)
0,1 0,3 0,3
\(m_{Fe_2O_3}=0,1\cdot160=16g\)
a)nH2 =6,72:22,4=0,3(mol)
PTHH Fe+H2SO4--->FeSO4+H2
theo pt , nFe = nH2 = 0,3 (mol)
=> mFe =n.M=0,3.56=16,8(g)
b) Ta có nH2=nFe=0,3(MOL)
Pthh: Fe2O3 + 3H2 ---> 2Fe + 3H2O
theo pt , nFe2O3=1/3 nH2=0,1(mol)
=> mFe2O3= n.M=0,1.(56.2+16.3)=16(g)
Vậy để có lượng sắt tham gia phản ứng trên phải có 16g Fe2O3 để tác dụng với H2
Cho mạt sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và người ta thu được 1,68 lit khí hidro (đktc). Viết phương trình phản ứng.
Cho bột sắt vào dung dịch chứa 19,6 gam H2SO4. Sau một thời gian bột sắt hòa tan hoàn toàn và người ta thu được 3,36 lít khí H2 (đktc)
a. Sau phản ứng có còn dư H2SO4 hay không? Nếu dư thì khối lượng là bao nhiêu?
b. Tính khối lượng sắt đã dùng.
c. Cho lượng khí Hidro ở trên tác dụng với 6,72 lít khí Oxi. Tính khối lượng chất còn dư sau phản ứng.
a, Ta có pt pư
\(Fe+H_2SO_4-->FeSO_4+H_2\)
Ta có
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
=> \(H_2SO_4\) dư
\(m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\)
\(\Rightarrow m_{dư\left(H_2SO_4\right)}=19,6-14,7=4,9\left(g\right)\)
b,
Ta có
\(m_{Fe}=0,15\cdot56=8,4\left(g\right)\)
( nốt câu c : vvvv )
.................................\(2H_2+O_2\rightarrow2H_2O\)
Trước phản ứng :......0,15...0,3.....................
Trong phản ứng :......0,15...0,075............
Sau phản ứng : ...........0......0,225........
=> Sau phản ứng H2 hết O2 còn dư ( dư 0,225 mol )
=> mdư = mO2 = 7,2 ( g )
Cho m (g) bột sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng .Sau một thời gian ,bột sắt tan hoàn toàn người ta thu được muối sắt (III) sunfat và thể tích khí hiđro thoát ra(ở đktc) . a/Viết PTHH .b/Tính khối lượng mạt sắt đã phản ứng .c/Để có lượng sắt tham gia phản ứng trên ,người ta phải dùng bao nhiêu gam sắt (III) oxit tác dụng với khí Hiđro .
Fe+H2SO4-->FeSO4+H2
theo PTHH=> nH2SO4=nFE=0,2mol
=>mFe=0,2.56=11,2gam
c) Fe2O3 + 3H2---> 2Fe +3 H2O
nFe=0,2 mol.Theo PTHH=> nFe2O3=0,1mol
=> KL Fe2O3 cần dùng là 0,1.160=16gam
Ta có: nH2SO4=0,2 (mol) (theo đầu bài)
PT:
Fe + H2SO4 -> FeSO4 + H2
1...........1.............1............1 (mol)
0,2 <- 0,2 -> 0,2 -> 0,2 (mol)
b) mFe=n.M=0,2.56=11,2(gam)
c) PT:
Fe2O3 + 3H2 -t0-> 2Fe + 3H2O
1................3..............2..............3 (mol)
0,1 <- 0,3 <- 0,2 -> 0,3 (mol)
=> mFe2O3=n.M=0,1.160=16(g)
Vậy khối lượng Fe2O3 cần dùng là 16 gam
a) PTHH: Fe + H2SO4 -> FeSO4 + H2 (1)
b) Ta có: \(n_{Fe}=n_{H_2SO_4}=0,2\left(mol\right)\)
=> \(m_{Fe}=0,2.56=11,2\left(g\right)\)
c) PTHH: Fe2O3 + 3H2 -to-> 2Fe + 3H2O (2)
Ta có: \(n_{Fe\left(2\right)}=n_{Fe\left(1\right)}=0,2\left(mol\right)\\ =>n_{Fe_2O_3\left(2\right)}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ =>m_{Fe_2O_3}=0,1.160=16\left(g\right)\)