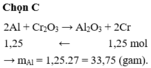Cho Na phản ứng với 300g HCL 15% tính khối lượng Na cần để phản ứng

Những câu hỏi liên quan
Đốt cháy 5,4 g Aluminium trong bình đựng khí Oxygen tinh khiết, sau phản ứng thu được Aluminium oxide.
a) Viết PTHH. Tính khối lượng Aluminium oxide thu được
b) Để có được lượng oxygen dùng cho phản ứng trên thì cần nhiệt phân bao nhiêu gam KClO3?
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
\(m_{Al_2O_3}=0,1\cdot102=10,2g\)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,1 0,15
\(m_{KClO_3}=0,1\cdot122,5=12,25g\)
Đúng 2
Bình luận (0)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(n_{Al}=5,4:27=0,2\left(mol\right)\)
\(\Rightarrow n_{Al_2O_3}=0,2.2:4=0,1\left(mol\right);n_{O_2}=0,2.3:4=0,15\left(mol\right)\)
\(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
b)\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(n_{O_2}=0,15\left(mol\right)\)(câu a)
\(\Rightarrow n_{KClO_3}=0,15.2:3=0,1\left(mol\right)\)
\(m_{KClO_3}=0,1.123,5=12,35\left(g\right)\)
Đúng 0
Bình luận (0)
Cho m gam bột sắt tác dụng hoàn toàn với dung dịch HCl 10% thu được 1,12lit khí hidro ( ở đktc )
a , Viết PTHH của phản ứng trên
b , Tính khối lượng bột sắt ( m )
c , Tính khối lượng dung dịch HCl cần dùng ( Biết : Fe = 56 ; H=1 )
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.05......0.1...................0.05\)
\(m_{Fe}=0.05\cdot56=2.8\left(g\right)\)
\(m_{dd_{HCl}}=\dfrac{0.1\cdot36.5\cdot100}{10}=36.5\left(g\right)\)
Đúng 0
Bình luận (0)
cho 6,5gam Zn tác đụng hết với HCl
a, viết phương trìng phản ứng sảy ra
b, tính số lượng HCl đã phản ứng
c, tính thể tích khí H2 sinh ra
d,khí H2 sinh ra cho phản ứng với CuO. tính số lượng CuO đã phản ứng
\(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 2 1 1
0,1 0,2 0,1
b, \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
c, \(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
d, PTHH : \(H_2+CuO\rightarrow Cu+H_2O\)
1 1 1 1
0,1 0,1
\(m_{CuO}=0,1.\left(64+16\right)=8\left(g\right)\)
Đúng 2
Bình luận (0)
Khối lượng bột nhôm cần dùng để thu được 65 gam crom từ C r 2 O 3 bằng phản ứng nhiệt nhôm (giả sử hiệu suất phản ứng là 100%) là
A. 40,5 gam.
B. 67,5 gam.
C. 33,75 gam.
D. 54,0 gam.
Cho 11,2 g một kim loại M tác dụng với khí clo dư thu được 32,5 g muối a) Xác định kim loại M b) Cần bao nhiêu gam dung dịch HCl 35,5% để phản ứng với KMnO4 dư để điều chế được lượng clo đã phản ứng ở trên
a) Gọi n là hóa trị của M
$2M + nCl_2 \xrightarrow{t^o} 2MCl_n$
Theo PTHH :
n M = n MCln
<=> 11,2/M = 32,5/(M + 35,5n)
<=> M = 56n/3
Với n = 3 thì M = 56(Fe)
Vậy M là Fe
b)
n Cl2 = (32,5 - 11,2)/71 = 0,3(mol)
$2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O$
n HCl = 16/5 n Cl2 = 0,96(mol)
m dd HCl = 0,96.36,5/35,5% = 98,704(gam)
Đúng 2
Bình luận (0)
Cho 7,5 gam axit aminoaxetic (H2NCH2COOH) phản ứng hết với dung dịch HCl. Sau phản ứng, khối lượng muối thu được là A. 11,05 gam B. 44,00 gam C. 43,00 gam D. 11,15 gam
Đọc tiếp
Cho 7,5 gam axit aminoaxetic (H2NCH2COOH) phản ứng hết với dung dịch HCl. Sau phản ứng, khối lượng muối thu được là
A. 11,05 gam
B. 44,00 gam
C. 43,00 gam
D. 11,15 gam
Hòa tan kim loại Fe vào dung dịch HCL 20%.Phản ứng vừa đủ thu được 14,874 lit Hydrogen(đktc) 25°C , 1 bar.Tính khối lượng kim loại Fe phản ứng ? a.Tính khối lượng dung dịch HCL 20% phản ứng ? b. Tính nồng độ % dung dịch sau phản ứng? c.Tính số ml dd Ca(OH)2 3M cần để trung hòa lượng acid HCl trên
Hòa tan kim loại Fe vào dung dịch HCL 20%.Phản ứng vừa đủ thu được 14,874 lit Hydrogen(đktc) 25°C , 1 bar.Tính khối lượng kim loại Fe phản ứng ?
a.Tính khối lượng dung dịch HCL 20% phản ứng ?
b. Tính nồng độ % dung dịch sau phản ứng?
c.Tính số ml dd Ca(OH)2 3M cần để trung hòa lượng acid HCl trên
giúp mình vs ạ
Hòa tan 16,6 gam hỗn hợp kim lọai Fe và Al cần dùng 300g dung dịch HCl, sau phản ứng thu được 11,2 lít khí H2 ở đktc
a. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu
b. Tính nồng độ phần tram của dung dịch HCl đã dùng
a, Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a--->2a------------------>a
2Al + 6HCl ---> 2AlCl3 + 3H2
b---->3b-------------------->1,5b
=> \(\left\{{}\begin{matrix}56a+27b=16,6\\a+1,5b=0,5\end{matrix}\right.\Leftrightarrow a=b=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) \(C\%_{HCl}=\dfrac{\left(0,2.2+0,2.3\right).36,5}{300}.100\%=12,167\%\)
Đúng 2
Bình luận (0)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
gọi nFe : a , nAl: b (a,b>0) => 56a + 27b = 16,6 (g)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b \(\dfrac{3b}{2}\)
=> \(a+\dfrac{3b}{2}=0,5\)
ta có hệ pt
\(\left\{{}\begin{matrix}56a+27b=16,6\\a+\dfrac{3b}{2}=0,5\end{matrix}\right.\)
=> a= 0,2 , b = 0,2
\(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=16,6-11,2=5,4\left(g\right)\end{matrix}\right.\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 0,4
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6
=> \(m_{HCl}=\left(0,4+0,6\right).36,5=36,5\left(g\right)\)
=> \(C\%=\dfrac{36,5}{200}.100\%=18,25\%\)
Đúng 0
Bình luận (1)