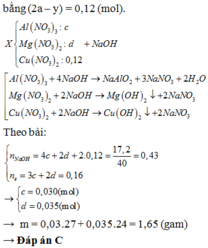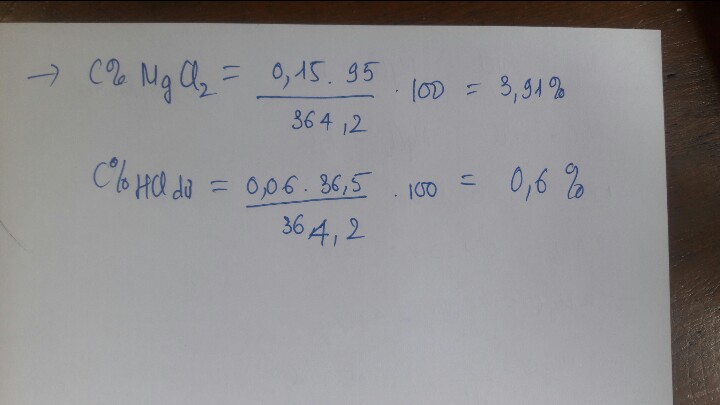Cho 17,2 gam hỗn hợp gồm K và K2O tác dụng với nước dư. Sau phản ứng thu được 2, 24 lít khí (đktc). Viết các PTHH xảy ra và gọi tên sản phẩm Tính khối lượng K; K2O có trong hỗn hợp ban đầu. (K = 39; O = 16; H = 1)

Những câu hỏi liên quan
Cho 42,7 gam hỗn hợp gồm Ba và BaO tác dụng với nước dư. Sau phản ứng thu được 4,48 lít khí (đktc). a. Viết các PTHH xảy ra và gọi tên sản phẩm b. Tính khối lượng Ba; BaO có trong hỗn hợp ban đầu. (Ba = 137; O = 16; H = 1)
a, \(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
Ba(OH)2: bari hydroxit
H2: hydro
b, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Ba}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Ba}=0,2.137=27,4\left(g\right)\)
\(\Rightarrow m_{BaO}=42,7-27,4=15,3\left(g\right)\)
Đúng 1
Bình luận (0)
12,5 gam hỗn hợp K và K2O vào nước thu được 2,479 lít khí
a) viết các pthh xảy ra
b) tính khối lượng từng chất lõng trong hỗn hợp ban đầu
c) tính khối lượng sản phẩm base thu được sau phản ứng
\(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
PTHH:
2K + 2H2O ---> 2KOH + H2
0,2<---------------0,2<----0,1
=> \(\left\{{}\begin{matrix}m_K=0,2.39=7,8\left(g\right)\\m_{K_2O}=12,5-7,8=4,7\left(g\right)\end{matrix}\right.\)
\(n_{K_2O}=\dfrac{4,7}{94}=0,05\left(mol\right)\)
PTHH: K2O + H2O ---> 2KOH
0,05-------------->0,1
=> mKOH = (0,2 + 0,1).56 = 16,8 (g)
Đúng 5
Bình luận (1)
2K+2H2O->2KOH+H2
0,2--------------0,2-------0,1mol
K2O+H2O->2KOH
0,05--------------0,1
n H2=0,1 mol
=>m K=0,2.39=7,8g
=>m K2O=4,7g=>n K2O=0,05 mol
=>m bazo=0,3.56=16,8g
Đúng 5
Bình luận (1)
Cho 10,1 gam hỗn hợp Na, K tác dụng với nước dư, sau phản ứng thu được 3,36 lít khí H2 (đktc). (a) Viết phương trình phản ứng xảy ra. (b) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(2Na+2H_2O\rightarrow2NaOH+H_2|\)
2 2 2 1
a 0,5a
\(2K+2H_2O\rightarrow2KOH+H_2|\)
2 2 2 1
b 0,5b
b) Gọi a là số mol của Na
b là số mol của K
\(m_{Na}+m_K=10,1\left(g\right)\)
⇒ \(n_{Na}.M_{Na}+n_K.M_K=10,1g\)
⇒ 23a + 39b = 10,1g (1)
Theo phương trình : 0,5a + 0,5b = 0,15(2)
Từ(1),(2), ta có hệ phương trình :
23a + 39b = 10,1g
0,5a + 0,5b = 0,15
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(m_{Na}=0,1.23=2,3\left(g\right)\)
\(m_K=0,2.39=7,8\left(g\right)\)
0/0Na = \(\dfrac{2,3.100}{10,1}=22,77\)0/0
0/0K = \(\dfrac{7,8.100}{10,1}=77,23\)0/0
Đúng 1
Bình luận (0)
Cho 17,2 gam hỗn hợp gồm K2O và K vào nước dư. Sau khi kết thúc phản ứng thu được 2,24 lít khí H2
a, Tính khối lượng mỗi chất trong hỗn hợp?
b, Dẫn khí H2 thu được ở trên qua 12 gam CuO nung nóng. Sau 1 thời gian thu được 10,8 gam chất rắn. Tính hiệu suất phản ứng
\(a,n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:2K+2H_2O\rightarrow2KOH+H_2\uparrow\\ Theo.pt:n_K=2n_{H_2}=2.0,1=0,2\left(mol\right)\\ m_K=0,2.39=7,8\left(g\right)\\ m_{K_2O}=17,2-7,8=9,4\left(g\right)\\ b,n_{CuO\left(bđ\right)}=\dfrac{12}{80}=0,15\left(mol\right)\\ PTHH:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\ LTL:0,15>0,1\Rightarrow Cu.dư\)
Gọi nCuO (pư) = a (mol)
=> nCu = a (mol)
mchất rắn sau pư = 80(0,15 - a) + 64a = 10,8
=> a = 0,075 (mol)
=> nH2 (pư) = 0,075 (mol)
\(H=\dfrac{0,075}{0,1}=75\%\)
Đúng 3
Bình luận (0)
Cho 17,2 gam hỗn hợp kim loại gồm Fe cà Cu tác dụng vừa đủ với dd H2SO4 đặc nóng dư thu được 6,72 lít khí SO2 (đktc) là sản phẩm khử duy nhất. Tính khối lượng mỗi muối và khối lượng dung dịch H2SO4 80% phản ứng
`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Đúng 4
Bình luận (0)
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho hỗn hợp T gồm CH4, C2H4 và C2H2. Lấy 4,3 gam T tác dụng hết với dung dịch brom (dư) thì khối lượng brom phản ứng là 24 gam. Mặt khác, nếu cho 6,72 lít hỗn hợp T (đktc) tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được 18 gam kết tủa. Viết các phương trình phản ứng xảy ra và tính % thể tích mỗi khí trong hỗn hợp T.
Đọc tiếp
Cho hỗn hợp T gồm CH4, C2H4 và C2H2. Lấy 4,3 gam T tác dụng hết với dung dịch brom (dư) thì khối lượng brom phản ứng là 24 gam. Mặt khác, nếu cho 6,72 lít hỗn hợp T (đktc) tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được 18 gam kết tủa. Viết các phương trình phản ứng xảy ra và tính % thể tích mỗi khí trong hỗn hợp T.
a) Các phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
C2H2 + Ag2O → C2Ag2 + H2O
Hay
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3
b) Gọi a, b, c lần lượt là số mol của CH4, C2H4, C2H2 trong 4,3gam hỗn hợp T.
– Số mol Br2 = 0,15 (mol); số mol kết tủa = số mol C2H2 = 0,075 (mol); số mol T = 0,3 (mol). Do đó nT = 4nC2H2
– Ta có hệ phương trình:
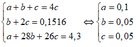
– Suy ra % thể tích mỗi khí trong T:
%VCH4 = 50%; %VC2H2 = %VC2H4 = 25%
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp gồm Al và Mg tác dụng với V lít dung dịch gồm
A
g
N
O
3
0,1M và
C
u
N
O
3
2
0,2M thu được dung dịch X và 11,2 gam chất rắn Y. Cho Y tác dụng với dung dịch
H
2
S
O
4
đặc, nóng...
Đọc tiếp
Cho m gam hỗn hợp gồm Al và Mg tác dụng với V lít dung dịch gồm A g N O 3 0,1M và C u N O 3 2 0,2M thu được dung dịch X và 11,2 gam chất rắn Y. Cho Y tác dụng với dung dịch H 2 S O 4 đặc, nóng (dư), thu được 1,792 lít khí S O 2 (ở đktc, là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào X thì có 17,2 gam NaOH phản ứng. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 1,74
B. 1,56
C. 1,65
D. 1,47
Cho 4,4 gam hỗn hợp X gồm Mg và MgO tác dụng với dung dịch HCl 3,65% (dư 20% so với lượng phản ứng) thu được dung dịch Y và 2,24 lít khí H2 (đktc). (a) Viết PTHH xảy ra và tính phần trăm khối lượng mỗi chất trong hỗn hợp X. (b) Tính nồng độ phần trăm các chất có trong dung dịch Y.
Cho 2,06 gam hỗn hợp X gồm Fe, Al, Zn và Cu tác dụng với dung dịch HNO3 loãng, dư, sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (đktc, sản phẩm khử duy nhất). Khối lượng muối nitrat sinh ra là A. 4,54 B. 9,5 C. 7,02 D. 7,44
Đọc tiếp
Cho 2,06 gam hỗn hợp X gồm Fe, Al, Zn và Cu tác dụng với dung dịch HNO3 loãng, dư, sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (đktc, sản phẩm khử duy nhất). Khối lượng muối nitrat sinh ra là
A. 4,54
B. 9,5
C. 7,02
D. 7,44