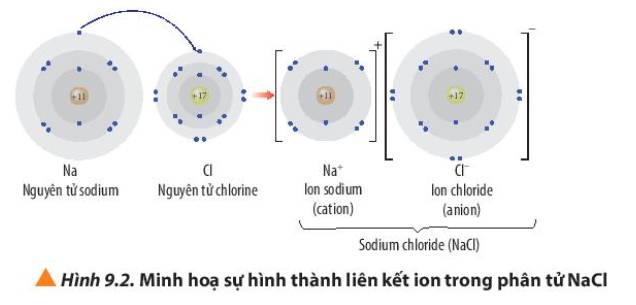
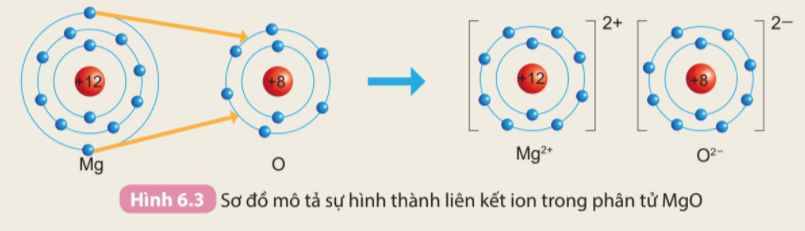
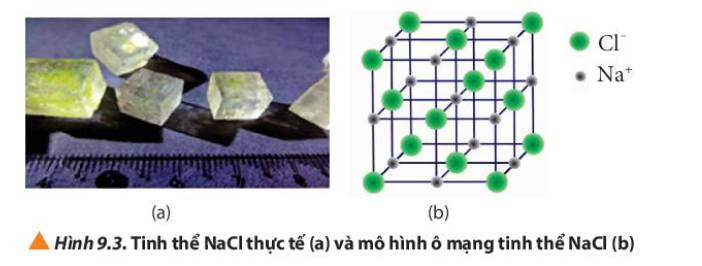
Hơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào máu, tăng cường hiệu quả điều trị. Trong đó, thường gặp nhất là các muối hydrochloride, sodium hoặc sulfate.
Muối thường là các hợp chất chứa liên kết ion. Liên kết ion là gì?