Lithium, sodium, potassium tác dụng với nước, chlorine, oxygenBa thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:Hoá chất: kim loại lithium, sodium, potassium, nước.Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậu thuỷ tinh, muôi sắt, dao, kẹp sắt.Thí nghiệm 1: Tác dụng với nướcTiến hành:Cho mỗi mẩu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy...
Đọc tiếp
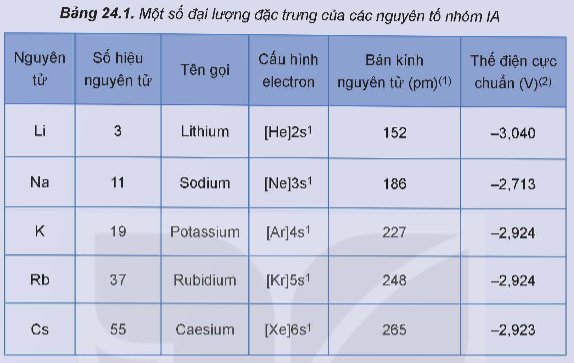
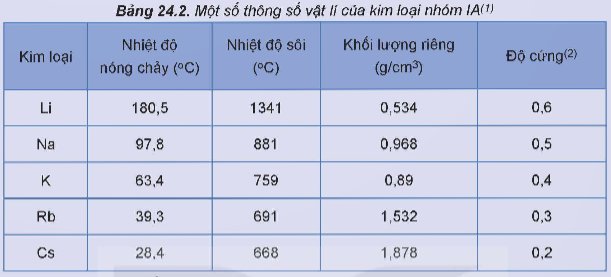
Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen
Ba thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:
Hoá chất: kim loại lithium, sodium, potassium, nước.
Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậu thuỷ tinh, muôi sắt, dao, kẹp sắt.
Thí nghiệm 1: Tác dụng với nước
Tiến hành:
Cho mỗi mẩu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.

Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hoá học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Thí nghiệm 2: Tác dụng với chlorine
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K. Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Thí nghiệm 3: Tác dụng với oxygen
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.


 2LiCl
2LiCl 2NaCl
2NaCl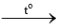 2KCl
2KCl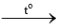 2Li2O
2Li2O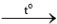 2Na2O
2Na2O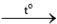 2K2O
2K2O