Bài 24: Nguyên tố nhóm IA
Nội dung lý thuyết
I. Đơn chất nhóm IA
1. Đặc điểm chung
- Nguyên tố nhóm IA là những nguyên tố s, chỉ có 1 electron hóa trị ở phân lớp ns1 và đứng đầu mỗi chu kì tương ứng.
- Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên dễ tách electron hóa trị ra khỏi nguyên tử. Vì vậy, trong các phản ứng hóa học, chúng dễ nhường 1 electron, thể hiện tính khử rất mạnh: M → M+ + 1e.
- Trong hợp chất, nguyên tử kim loại nhóm IA chỉ thể hiện số oxi hóa +1.
2. Trạng thái tự nhiên
- Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất (chủ yếu là dạng muối). Sodium và potassium là hai nguyên tố phổ biến trong vỏ Trái Đất, có nhiều trong nước biển, mỏ muối, quặng halite (NaCl), quặng sylvinite (NaCl.KCl).
3. Tính chất vật lí
a) Nhiệt độ nóng chảy và nhiệt độ sôi
- Các kim loại nhóm IA có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn so với các kim loại khác.
- Từ Li đến Cs, nhiệt độ nóng chảy và nhiệt độ sôi giảm dần.
b) Khối lượng riêng
Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạnh tinh thể kém đặc khít.
c) Độ cứng
Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thấp (đều mềm, có thể cắt bằng dao, kéo).
4. Tính chất hóa học
- Kim loại kiềm là những kim loại hoạt động hóa học mạnh, có tính khử mạnh và tăng dần từ Li đến Cs.
- Các kim loại kiềm có thế điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường, với các phi kim với mức độ tăng dần từ Li đến Cs.
5. Bảo quản
Các kim loại nhóm IA được bảo quản trong dầu hỏa, trong chân không hoặc trong khí hiếm.
Ví dụ: Na, K thường được bảo quản bằng cách ngâm trong dầu hỏa khan; Rb, Cs thường được bảo quản trong các ống thủy tinh hàn kín.

II. Hợp chất của kim loại nhóm IA
1. Đặc điểm chung
- Các hợp chất của kim loại kiềm thường dễ tan trong nước và tạo thành dung dịch chất điện li mạnh.
- Ở nhiệt độ thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt cháy kim loại kiềm hoặc các hợp chất của chúng trên ngọn lửa không màu làm ngọn lửa có màu đặc trưng. Do vậy, có thể nhận biết hợp chất của kim loại nhóm IA bằng màu của ngọn lửa.

+ Hợp chất của Li: ngọn lửa màu đỏ.
+ Hợp chất của Na: ngọn lửa màu vàng.
+ Hợp chất của K: ngọn lửa màu tím
2. Hợp chất quan trọng
a) Sodium chloride
- Ứng dụng:
+ Trong đời sống: gia vị, bảo quản và chế biến thực phẩm,...
+ Trong y học: nước muối sinh lí, chất điện giải,...
+ Trong công nghiệp hóa chất: sản xuất chlorine – kiềm, nước Javel, soda,...
- Quá trình điện phân dung dịch NaCl
Trong công nghiệp chlorine – kiềm, quá trình điện phân dung dịch NaCl bão hòa có màng ngăn điện cực được ứng dụng để sản xuất xút công nghiệp (NaOH), khí chlorine (Cl2). Điện phân dung dịch NaCl bão hòa không có màng ngăn điện cực được ứng dụng để sản xuất nước Javel (chứa NaClO).
b) Sodium hydrogencarbonate, sodium carbonate
- Ứng dụng:
+ Sodium hydrogencarnonate: bột nở trong chế biến thực phẩm, chất chữa cháy dạng bột, viên sủi, điều chỉnh pH,...
+ Sodium carbonate: nguyên liệu sản xuất thủy tinh, xà phòng, bột giặt, giấy, sợi, chất tẩy rửa,...; xử lí, làm mềm nước, điều chế các muối khác,...; tác nhân tẩy sạch vết dầu mỡ trên chi tiết máy trước khi sơn, hàn, mạ điện,...
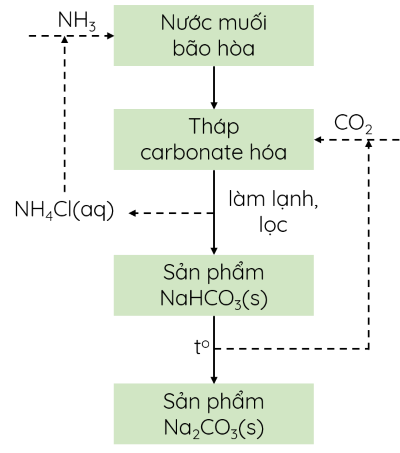
- Sản xuất: phương pháp Solvay
+ Nguyên liệu: đá vôi, muối ăn, ammonia, nước,...
+ Giai đoạn tạo NaHCO3:
NaCl + NH3 + CO2 + H2O ⇌ NaHCO3 + NH4Cl
Khi làm lạnh, NaHCO3 kết tinh và được lọc, tách khỏi hệ phản ứng.
+ Giai đoạn tạo Na2CO3:
2NaHCO3 \(\underrightarrow{t^o}\) Na2CO3 + CO2 + H2O