Thuốc thử Tollens chứa hợp chất có công thức là [Ag(NH3)2]OH, có khả năng tham gia phản ứng tráng bạc với aldehyde.
Phân tử [Ag(NH3)2]OH hoặc cation [Ag(NH3)2]+ đều được gọi là phức chất. Vậy phức chất là gì? Phức chất có cấu tạo như thế nào?
Thuốc thử Tollens chứa hợp chất có công thức là [Ag(NH3)2]OH, có khả năng tham gia phản ứng tráng bạc với aldehyde.
Phân tử [Ag(NH3)2]OH hoặc cation [Ag(NH3)2]+ đều được gọi là phức chất. Vậy phức chất là gì? Phức chất có cấu tạo như thế nào?
Từ công thức Lewis của NH3, giải thích vì sao phân tử này có thể đóng vai trò là phối tử.
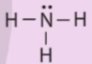
Thảo luận (1)Hướng dẫn giảiTừ công thức Lewis của NH3, ta thấy phân tử NH3 còn một cặp electron chưa tham gia liên kết. Cặp electron chưa tham gia liên kết này có thể tạo liên kết cho nhận với orbital trống của nguyên tử trung tâm tạo phức chất.
Do đó phân tử NH3 có thể đóng vai trò là phối tử.
(Trả lời bởi Nguyễn Quốc Đạt)
Hãy chỉ ra nguyên tử trung tâm và phối tử trong phức chất (3).
Thảo luận (2)Hướng dẫn giải
Khi cho copper(II) sulfate vào nước thì hình thành phức chất bát diện với các phối tử là 6 phân tử H2O.
a) Viết công thức của phức chất.
b) Vẽ dạng hình học của phức chất trên.
Thảo luận (1)Hướng dẫn giảia) Công thức của phức chất: [Cu(OH2)6]2+ hay [Cu(OH2)6]SO4
b) Dạng hình học của phức chất: [Cu(OH2)6]2+
(Trả lời bởi Nguyễn Quốc Đạt)
Thực nghiệm xác nhận phức chất [Zn(OH)4]2- có dạng hình học tứ diện. Hãy vẽ dạng hình học của phức chất trên.
Thảo luận (1)Hướng dẫn giải
Cho một phức chất có công thức [Fe(OH2)6](NO3)3.3H2O.
Chỉ ra nguyên tử trung tâm và phối tử của phức chất trên.
Thảo luận (1)Hướng dẫn giải
Hãy chỉ ra liên kết cho – nhận trong phức chất K2[PtCl4]2-.
Thảo luận (1)Hướng dẫn giảiLiên kết cho – nhận trong phức chất [PtC14]2- là: mỗi anion Cl- cho một cặp electron chưa liên kết vào orbital trống của cation Pt2+.
(Trả lời bởi Nguyễn Quốc Đạt)
Mỗi phát biểu dưới đây là đúng hay sai?
(1) Phức chất có thể mang điện tích hoặc không mang điện tích
(2) Phức chất mà nguyên tử trung tâm tạo 4 liên kết với các phối tử luôn có dạng hình học là tứ diện
(3) Giống như phân tử amionia (NH3), phân tử methyl amine (CH3NH2) cũng có thể đóng vai trò là phối tử do các cặp electron chưa liên kết.
Thảo luận (1)Hướng dẫn giải(1) Phức chất có thể mang điện tích hoặc không mang điện tích. ⇒ Đúng.
(2) Phức chất mà nguyên tử trung tâm tạo 4 liên kết ở với các phối tử luôn có dạng hình học là tứ diện. ⇒ Sai vì ngoài dạng hình học là tứ diện còn có thể là dạng vuông phẳng.
(3) Giống như phân tử amionia , phân tử methyl aminecũng có thể đóng vai trò là phối tử do có cặp electron chưa liên kết. ⇒ Đúng.
(Trả lời bởi Nguyễn Quốc Đạt)