Vì sao các khoáng vật calcite, dolomite,… hầu như không tan trong nước?

Vì sao các khoáng vật calcite, dolomite,… hầu như không tan trong nước?

Phản ứng giữa các chất nào sau đây tạo ra chất không tan?
a) K2CO3 + Ca(OH)2 → ?
b) H2SO4 + NaOH → ?
c) HNO3 + Mg(OH)2 → ?
d) Na2SO4 + Ba(OH)2 → ?
Thảo luận (1)Hướng dẫn giảia) K2CO3 + Ca(OH)2 ⟶ 2KOH + CaCO3
b) H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
c) 2HNO3 + Mg(OH)2 ⟶ Mg(NO3)2 + 2H2O
d) Na2SO4 + Ba(OH)2 ⟶ 2NaOH + BaSO4
Mà CaCO3 và BaSO4 là chất không tan trong nước.
Vậy phản ứng a và d tạo ra chất không tan.
(Trả lời bởi Nguyễn Quốc Đạt)
So sánh độ tan của muối BaSO4 và CaSO4
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2, CaCl2 cùng nồng độ 0,1M; dung dịch CuSO4 5%.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho 2ml dung dịch BaCl2 vào ống nghiệm (1), 2ml dung dịch CaCl2 vào ống nghiệm (2). Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại
Yêu cầu: Quan sát hiện tượng, so sánh thời điểm xuất hiện kết tủa trong mỗi ống nghiệm, giải thích.
Thảo luận (1)Hướng dẫn giảiHiện tượng:
- Ống nghiệm (1) xuất hiện kết tủa trắng. Ống nghiệm (2) xuất hiện vẩn đục trắng.
- Thời điểm xuất hiện kết tủa ở ống nghiệm (1): ngay sau khi cho dung dịch CuSO4 vào. Thời điểm xuất hiện kết tủa ở ống nghiệm (2): sau khi cho dung dịch CuSO4 vào một lúc.
Phương trình hóa học:
BaCl2(aq) + CuSO4(aq) ⟶ CuCl2(aq) + BaSO4(s)
CaCl2(aq) + CuSO4(aq) ⟶ CuCl2(aq) + CaSO4(s)
Giải thích: Vì BaSO4 không tan trong nước còn CaSO4 ít tan trong nước.
(Trả lời bởi Nguyễn Quốc Đạt)
Magnesium là kim loại cơ bản trong hợp kim dùng để chế tạo khung và cánh của các thiết bị bay (Hình 18.3). Theo em, ứng dụng trên dựa vào tính chất vật lí nào của hợp kim magnesium?

Thảo luận (1)Hướng dẫn giảiMagnesium là kim loại cơ bản trong hợp kim dùng để chế tạo khung và cánh của các thiết bị bay.
Ứng dụng này dựa trên tính chất nhẹ, cứng và bền của hợp kim magnesium.
(Trả lời bởi Nguyễn Quốc Đạt)
Tìm hiểu và cho biết ngoài tham gia tạo hợp kim, các kim loại nhóm IIA còn có những ứng dụng nào khác.
Thảo luận (1)Hướng dẫn giảiNgoài tham gia tạo hợp kim, các kim loại nhóm IIA còn có những ứng dụng như:
- Be: được sử dụng trong các vũ khí hạt nhân.
- Mg: được dùng để sản xuất pháo hoa.
- Ca: được dùng để điều chế các kim loại khác như uranium, thorium.
- Sr: được dùng để sản xuất pháo hoa.
- Ba: được dùng làm chất cản quang trong y tế.
…
(Trả lời bởi Nguyễn Quốc Đạt)
Vì sao magnesium phản ứng rất chậm với nước?

Thảo luận (1)Hướng dẫn giảiMagnesium phȧn ứng rất chậm với nước là vì độ tan trong nước của Mg(OH)2 tạo thành là rất thấp (0,0012 g/100 g nước ở 20°C). Phần Mg(OH)2 không tan này bám trên bề mặt Mg làm cản trở quá trình tiếp xúc của Mg với nước.
(Trả lời bởi Nguyễn Quốc Đạt)
Dựa vào tính khử của kim loại và độ tan của các hydroxide, dự đoán:
a) Magnesium hay barium phản ứng với oxygen mạnh hơn
b) Calcium hay barium phản ứng với nước mạnh hơn.
Thảo luận (1)Hướng dẫn giảia) Trong nhóm IIA, tính khử của kim loại tăng từ Be đến Ba. Do đó tính khử của Ba mạnh hơn Mg. Nên barium phản ứng với oxygen mạnh hơn magnesium.
b) Tính khử của Ca < Ba và độ tan trong nước của Ca(OH)2 cũng thấp hơn Ba(OH)2. Do đó barium phȧn ứng với nước mạnh hơn calcium.
(Trả lời bởi Nguyễn Quốc Đạt)
Trong cùng chu kì, kim loại nhóm IIA có tính khử mạnh hơn hay yếu hơn so với tính khử của kim loại nhóm IA. Giải thích.
Thảo luận (1)Hướng dẫn giảiTrong cùng chu kì, kim loại nhóm IIA có tính khử yếu hơn so với tính khử của kim loại nhóm IA.
Vì trong cùng một chu kì, từ nhóm IA sang nhóm IIA điện tích hạt nhân tăng, bán kính nguyên tử giảm làm lực hút electron lớp ngoài cùng tăng. Do đó khả năng nhường electron lớp ngoài cùng (để thể hiện tính khử) của kim loại nhóm IIA khó hơn so với kim loại nhóm IA.
(Trả lời bởi Nguyễn Quốc Đạt)
Nguyên tố nhóm IIA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn (Hình 18.1).
a) Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IIA mà em biết.
b) Kim loại nhóm IIA có những tính chất vật lí và tính chất hóa học nào?
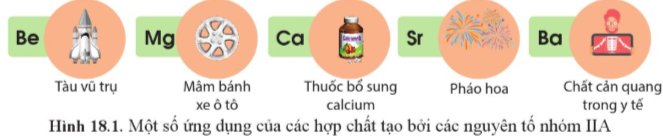
Thảo luận (1)Hướng dẫn giảia) Một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IIA mà em biết:
- Mg: tham gia tạo hợp kim.
- Ba: làm chất cản quang trong y tế.
- Be: làm vật liệu sản xuất tên lửa, tàu vũ trụ.
- CaCO3 (đá vôi): sản xuất vôi sống, xi măng.
- CaO (vôi sống): khử chua, tẩy uế, hút ẩm, vật liệu xây dựng, …
…
b) Kim loại nhóm IIA có những tính chất vật lí: nhẹ, khối lượng riêng nhỏ, nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA nhưng tương đối thấp so với các kim loại khác.
Kim loại nhóm IIA có tính chất hóa học: Tính khử: M ⟶ M2+ + 2e. Tác dụng với các chất oxi hóa như phi kim (O2, Cl2, …), H2O, acid, …
(Trả lời bởi Nguyễn Quốc Đạt)