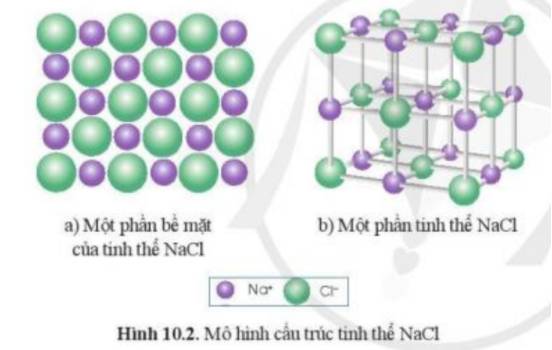
Từ mô hình NaCl, có thể thấy được xung quanh mỗi ion Na+ có 6 ion Cl-
Bài 10: Liên kết ion
Đúng 0
Bình luận (0)
Các câu hỏi tương tự
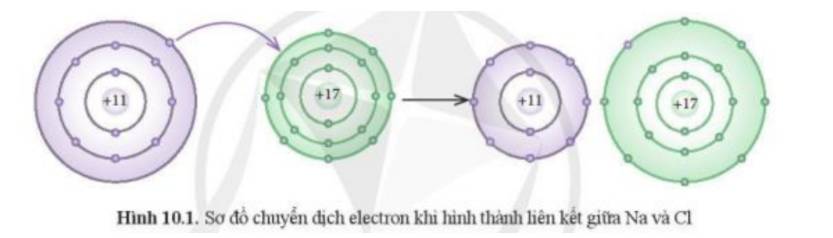
Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
Lắp ráp mô hình tinh thể NaCl: Quan sát Hình 10.2b để lắp ráp mô hình tinh thể NaCl từ các quả cầu minh họa cho Na+, Cl- và que nối.
Hãy kể tên một số hợp chất ion có xung quanh em và cho biết trong điều kiện thường, chúng tồn tại ở thể nào.
Cho các ion: Li+, Ca2+, Al3+, F-, O2-, PO43-. Hãy viết công thức tất cả các hợp chất ion (tạo nên từ một loại cation và một loại anion) có thể được tạo thành từ các ion đã cho. Biết rằng tổng điện tích của các ion trong hợp chất bằng 0.
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b) Vì sao cả Na2O và MgO đều là chất rắn ở nhiệt độ thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Hãy nêu một số hợp chất ion:
a) Tạo nên bởi các ion đơn nguyên tử
b) Tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử
c) Tạo nên bởi các ion đa nguyên tử
Cho các chất sau: SiO2 là thành phần chính của thạch anh, CaCO3 là thành phần của đá vôi. Hãy cho biết chất nào được tạo nên bởi liên kết ion? Giải thích.
Phát biểu nào sau đây là đúng?
a) Liên kết ion chỉ có trong đơn chất
b) Liên kết ion chỉ có trong hợp chất
c) Liên kết ion có trong cả đơn chất và hợp chất
Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao
(c) Thường tồn tại ở thể rắn trong điều kiện thường
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp


