Nguyên tố có tính phi kim mạnh nhất là `F`
Vì (không xét trường hợp của khí hiếm)
- Ở mỗi chu kì tính phi kim tăng dần từ trái qua phải `(1)`
- Ở mỗi nhóm tính phi kim giảm dần từ trên xuống dưới `(2)`
Từ `(1);(2)=>F` có tính phi kim mạnh nhất.
Nguyên tố có tính phi kim mạnh nhất là `F`
Vì (không xét trường hợp của khí hiếm)
- Ở mỗi chu kì tính phi kim tăng dần từ trái qua phải `(1)`
- Ở mỗi nhóm tính phi kim giảm dần từ trên xuống dưới `(2)`
Từ `(1);(2)=>F` có tính phi kim mạnh nhất.
Aspartame là một chất làm ngọt nhân tạo, được sử dụng trong một số loại soda dành cho người ăn kiêng. Xác định vị trí của các nguyên tố tạo nên aspartame trong bảng tuần hoàn. Trong số các nguyên tố đó, nguyên tố nào có tính phi kim mạnh nhất?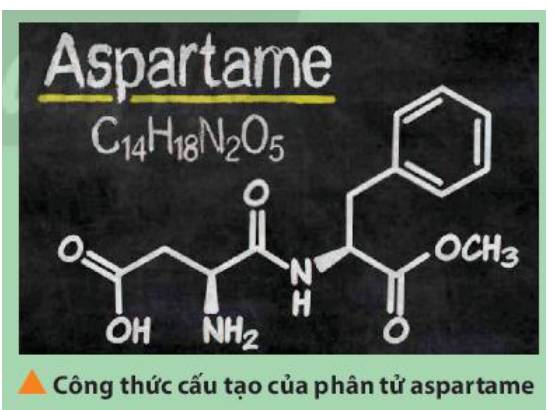
Dựa vào xu hướng biến đổi tính kim loại – phi kim của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các nguyên tố sau đây theo chiều giảm dần tính kim loại: sodium, magnesium và potassium.
Bốn nguyên tố D, E, M, Q cùng thuộc một nhóm A trong bảng tuần hoàn, có số hiệu nguyên tử lần lượt là 9, 17, 35, 53. Các nguyên tố này được sắp xếp theo chiều tính phi kim tăng dần theo dãy nào sau đây?
A. D, Q, E, M
B. Q, M, E, D
C. D, E, M, Q
D. D, M, E, Q
Kim loại kiềm là các kim loại nhóm IA, bao gồm: lithium (Li), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr). Chúng phản ứng được với nước và giải phóng khí hydrogen. Vậy khả năng phản ứng với nước của các kim loại trên có giống nhau hay không? Dựa vào bảng tuần hoàn các nguyên tố hóa học, chúng ta có thể giải thích được xu hướng biến đổi tính chất hóa học cơ bản của nguyên tử các nguyên tố không?
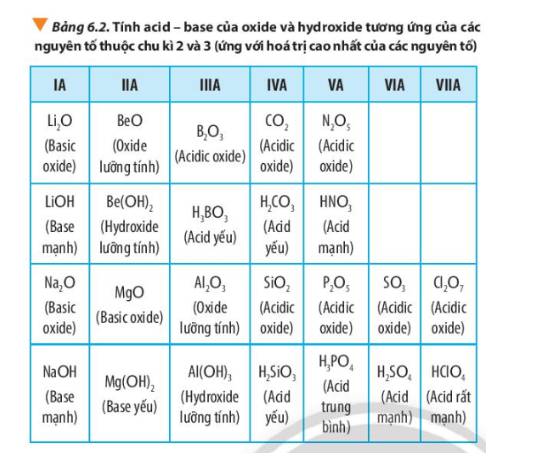
Quan sát Bảng 6.2, hãy liên hệ xu hướng biến đổi tính acid, tính base của oxide và hydroxide tương ứng với tính kim loại, phi kim của các nguyên tố trong chu kì.
Dựa vào xu hướng biến đổi độ âm điện của nguyên tử các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần độ âm điện của nguyên tử: Na, K, Mg, Al.
Dựa vào xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử: Li, N, O, Na, K.
Hãy cho biết vì sao trong Bảng 6.1, giá trị độ âm điện của nguyên tử các nguyên tố nhóm VIIIA còn để trống.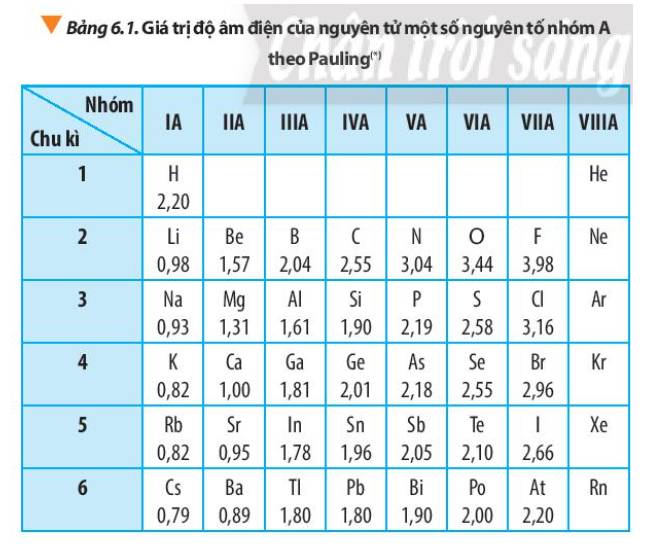
Từ số liệu trong Bảng 6.1, nhận xét sự biến đổi giá trị độ âm điện của nguyên tử các nguyên tố trong một nhóm A và trong một chu kì. Giải thích.