Thể tích dung dịch Na2S2O3 càng nhiều => Nồng độ Na2S2O3 càng cao => Thời gian xuất hiện kết tủa càng nhanh
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
Đúng 1
Bình luận (0)
Các câu hỏi tương tự
Tiến hành thí nghiệm 3, quan sát hiện tượng và so sánh sự thay đổi của tàn đóm ở 2 ống nghiệm.
Nhận xét mối liên hệ giữa tốc độ phản ứng với kích thước của CaCO3.
Quan sát Hình 16.7, giải thích kết quả của thí nghiệm 2.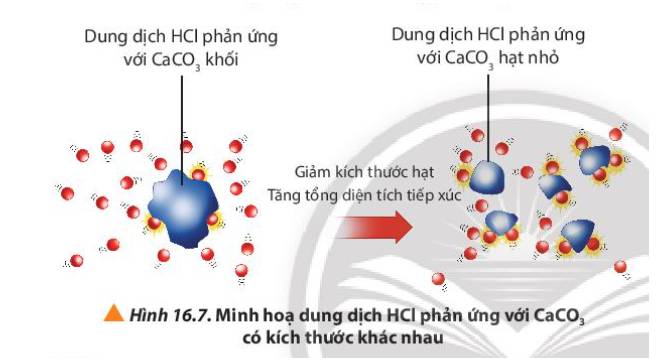
Giữ nguyên nồng độ dung dịch Na2S2O3 ban đầu, pha loãng dung dịch H2SO4 tương tự như cách pha loãng dung dịch Na2S2O3 theo Bảng 16.1, kết quả thí nghiệm sẽ thay đổi thế nào?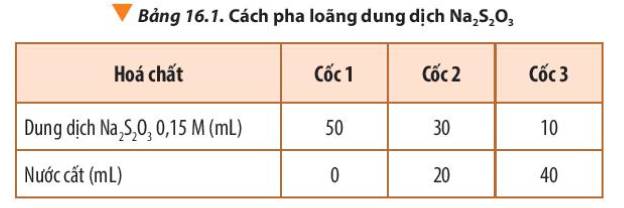
Quan sát Hình 16.2 và phương trình hóa học của phản ứng, giải thích kết quả thí nghiệm 1.

Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây:a) Thay a g Zn hạt bằng a g bột Znb) Thay dung dịch HCl 2M bằng dung dịch HCl 1Mc) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
Đọc tiếp
Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây:
a) Thay a g Zn hạt bằng a g bột Zn
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
Tiến hành thí nghiệm 2 và so sánh tốc độ khí thoát ra trong hai bình tam giác.Thí nghiệm 2: Ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứngHóa chất: Dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.Tiến hành:Bước 1: Cân khoảng 2 g CaCO3, mỗi loại, cho vào 2 bình tam giác (1), (2).Bước 2: Đong khoảng 20 mL dung dịch HCl, rót đồng thời vào mỗi bình tam giác.Phương trình hóa học của phản ứng:CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + C...
Đọc tiếp
Tiến hành thí nghiệm 2 và so sánh tốc độ khí thoát ra trong hai bình tam giác.
Thí nghiệm 2: Ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
Hóa chất: Dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.
Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.
Tiến hành:
Bước 1: Cân khoảng 2 g CaCO3, mỗi loại, cho vào 2 bình tam giác (1), (2).
Bước 2: Đong khoảng 20 mL dung dịch HCl, rót đồng thời vào mỗi bình tam giác.
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)

Quan sát Hình 16.3, nhận xét sự ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
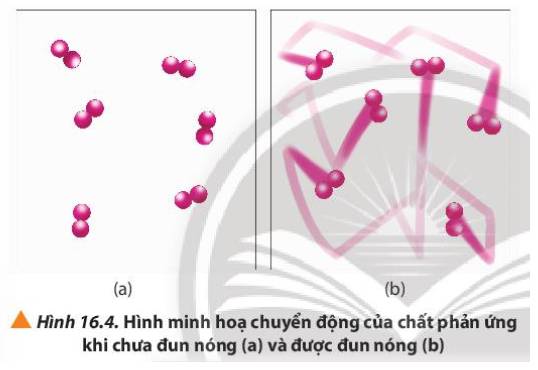
Quan sát Hình 16.4 và phương trình hóa học của phản ứng, giải thích vì sao tốc độ mất màu của KMnO4 trong 2 cốc không giống nhau.