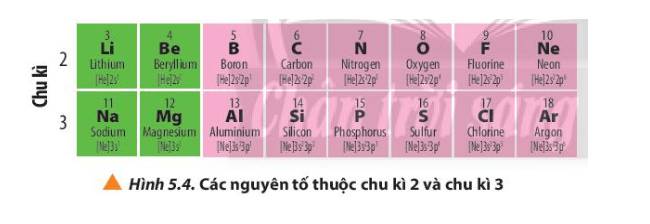
Số lớp eletron trong nguyên tử của các nguyên tố cùng chu kì đều bằng nhau.
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Đúng 1
Bình luận (0)
Các câu hỏi tương tự
Quan sát Hình 5.2, dựa vào cấu hình electron nguyên tử, hãy nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử các nguyên tố với số thứ tự nhóm của nguyên tố nhóm B. Nêu rõ các trường hợp đặc biệt.
Quan sát Hình 5.2, nhận xét đặc điểm cấu hình electron nguyên tử của các nguyên tố trong cùng một nhóm A.
Quan sát Hình 5.5, nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử với số thứ tự nhóm của nguyên tố nhóm A.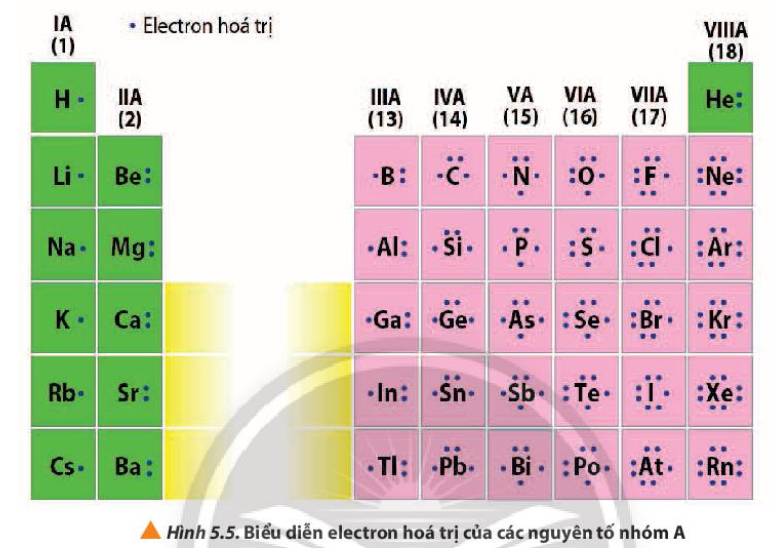
Quan sát Hình 5.2, nhận xét chiều tăng điện tích hạt nhân nguyên tử các nguyên tố trong chu kì và nhóm.
Dựa vào cấu hình electron, em hãy cho biết nguyên tố có số hiệu nguyên tử là 20 thuộc chu kì nào trong bảng tuần hoàn.
Quan sát Hình 5.3, cho biết số electron lớp ngoài cùng, số proton của nguyên tử aluminium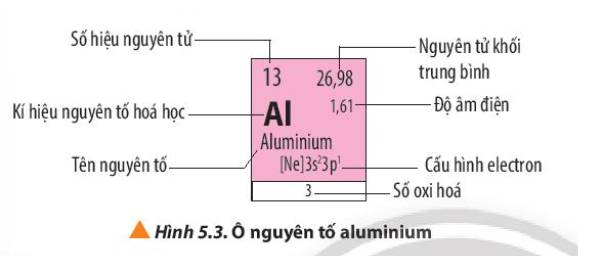
Viết cấu hình electron nguyên tử của các nguyên tố sau:
a) Nguyên tố thuộc chu kì 4, nhóm IIA
b) Nguyên tố khí hiếm thuộc chu kì 3
Dựa vào cấu hình electron, cho biết nguyên tố có số hiệu nguyên tử là 6, 8, 18, 20 thuộc khối nguyên tố nào trong bảng tuần hoàn. Chúng là kim loại, phi kim hay khí hiếm?
Quan sát Hình 5.1, hãy mô tả bảng tuần hoàn các nguyên tố hóa học của Mendeleev. Nhận xét về cách sắp xếp các nguyên tố hóa học theo chiều từ trên xuống dưới trong cùng một cột.