a)He -> số e ngoài cùng: 2
b)Ne -> số e ngoài cùng: 8
c) Ar-> số e ngoài cùng: 8
a)He -> số e ngoài cùng: 2
b)Ne -> số e ngoài cùng: 8
c) Ar-> số e ngoài cùng: 8
Quan sát hình 5.9, hãy cho biết nguyên tử H trong phân tử hydrogen có lớp vỏ tương tự khí hiếm nào

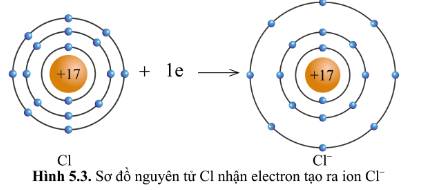
Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào.

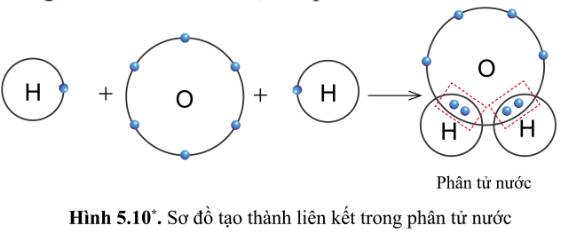
Quan sát hình 5.10, cho biết trong phân tử nước, mỗi nguyên tử H và O có bao nhiêu electron ở lớp ngoài cùng
Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron ngoài cùng bền vững. Nguyên tử của các nguyên tố khác luôn có xu hướng tham gia liên kết để có được lớp electron ngoài cùng bền vững tương tự khí hiếm. Vậy liên kết giữa các nguyên tử được hình thành như thế nào?

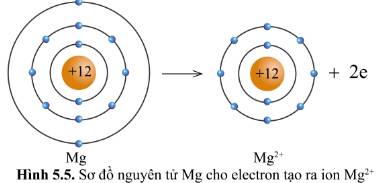
Quan sát các hình 5.5 và 5.6, cho biết các ion Mg2+ và O2- có lớp vỏ tương tự khí hiếm nào.

Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine
Quan sát hình 5.11, hãy cho biết trong phân tử khí carbonic, nguyên tử C có bao nhiêu electron dùng chung với nguyên tử O

Quan sát hình 5.5, hãy so sánh về số electron, số lớp electron giữa nguyên tử Mg và ion Mg2+

Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+
