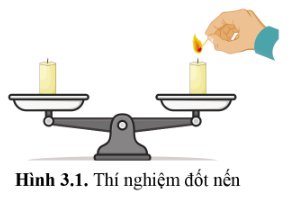
Đặt hai cây nến trên đĩa cân, cân ở vị trí thăng bằng. Nếu đốt một cây nến, sau một thời gian, cân không còn thăng bằng. Do cây nến bị đốt đã ngắn lại và không còn nặng như ban đầu.
Bài 3: Định luật bảo toàn khối lượng. Phương trình hóa học
Đúng 1
Bình luận (0)
Các câu hỏi tương tự
Trở lại thí nghiệm trong hoạt động mở đầu: Cân có còn giữ ở vị trí thăng bằng không? Giải thích.
Chuẩn bị:● Dụng cụ: Cân điện tử, bình tam giác (loại 100 ml), ống hút nhỏ giọt, ống đong.● Hoá chất: Dung dịch sodium sulfate (Na2SO4), dung dịch barium chloride (BaCl2).Tiến hành:- Đặt bình tam giác trong đó có chứa 10 ml dung dịch BaCl2 trên đĩa cân điện tử và lấy đầy dung dịch Na2SO4 vào ống hút nhỏ giọt có bóp cao su đậy lên miệng bình (hình 3.2a). Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mA).- Bóp nút cao su cho dung dịch Na2SO4 chảy xuống bình (hình 3.2b). Quan sát dấu hiệu của...
Đọc tiếp
Chuẩn bị:
● Dụng cụ: Cân điện tử, bình tam giác (loại 100 ml), ống hút nhỏ giọt, ống đong.
● Hoá chất: Dung dịch sodium sulfate (Na2SO4), dung dịch barium chloride (BaCl2).Tiến hành:
- Đặt bình tam giác trong đó có chứa 10 ml dung dịch BaCl2 trên đĩa cân điện tử và lấy đầy dung dịch Na2SO4 vào ống hút nhỏ giọt có bóp cao su đậy lên miệng bình (hình 3.2a). Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mA).
- Bóp nút cao su cho dung dịch Na2SO4 chảy xuống bình (hình 3.2b). Quan sát dấu hiệu của phản ứng xảy ra. Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mB).
● Mô tả hiện tượng thí nghiệm, cho biết khối lượng mA và mB.
● So sánh mA và mB, từ đó rút ra nhận xét về tổng khối lượng của các chất trước và tổng khối lượng của các chất sau phản ứng.

Chuẩn bị:● Dụng cụ: Cân điện tử, bình tam giác (loại 100 ml), ống đong.● Hoá chất: Bột sodium hydrogencarbonate (NaHCO3), dung dịch giấm ăn (CH3COOH).Tiến hành:Bước 1: Đặt bình tam giác có chứa 10 ml giấm ăn và một mẩu giấy có chứa một thì cafe bột NaHCO3 trên đĩa cân điện tử. Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mA).Bước 2: Đổ bột NaHCO3 vào bình tam giác, đặt lại mẩu giấy lên đĩa cân, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mB).● Mô tả hiện tượng thí nghiệm, cho biết...
Đọc tiếp
Chuẩn bị:
● Dụng cụ: Cân điện tử, bình tam giác (loại 100 ml), ống đong.
● Hoá chất: Bột sodium hydrogencarbonate (NaHCO3), dung dịch giấm ăn (CH3COOH).Tiến hành:
Bước 1: Đặt bình tam giác có chứa 10 ml giấm ăn và một mẩu giấy có chứa một thì cafe bột NaHCO3 trên đĩa cân điện tử. Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mA).
Bước 2: Đổ bột NaHCO3 vào bình tam giác, đặt lại mẩu giấy lên đĩa cân, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mB).
● Mô tả hiện tượng thí nghiệm, cho biết khối lượng mA và mB.
● So sánh mA và mB. Giải thích.
Giải quyết tình huống:
a) Khi đốt cháy hoàn toàn một mẩu gỗ, ta thu được tro có khối lượng nhẹ hơn mẩu gỗ ban đầu. Theo em, sự thay đổi khối lượng này có mâu thuẫn với định luật bảo toàn khối lượng không?
b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng định luật bảo toàn khối lượng trong tình huống trên.
Trong dạ dày người có một lượng hydrochloric acid (HCl) tương đối ổn định, có tác dụng trong tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (NaHCO3) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:NaHCO3 + HCl → NaCl + H2O + CO2↑ *Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
Đọc tiếp
Trong dạ dày người có một lượng hydrochloric acid (HCl) tương đối ổn định, có tác dụng trong tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (NaHCO3) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
NaHCO3 + HCl → NaCl + H2O + CO2↑ *
Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
Tìm hiểu và viết một bài thuyết trình (khoảng 200 từ) về thân thế, sự nghiệp khoa học của hai nhà bác học Lô – mô – nô – xốp và La – voa – đi – ê.
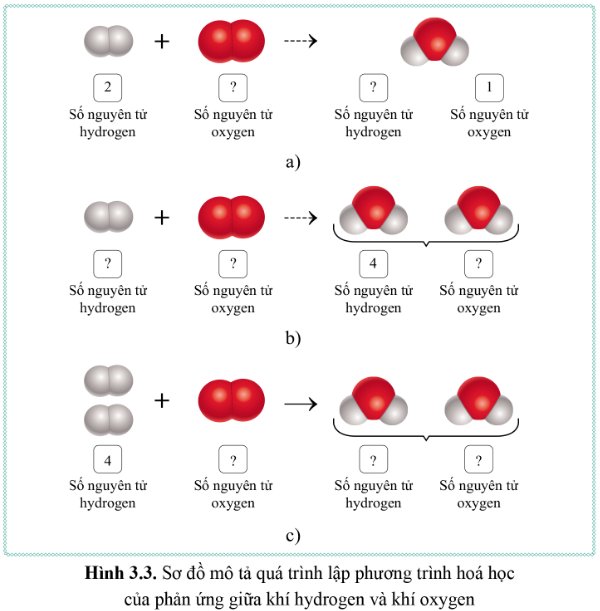
Cho biết số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng và các chất sản phẩm trong các ô trống trên hình 3.3.
Lập phương trình hoá học của phản ứng khi cho dung dịch sodium carbonate (Na2CO3) tác dụng với dung dịch calcium hydroxide (Ca(OH)2) tạo thành calcium carbonate (CaCO3) không tan (kết tủa) và sodium hydroxide (NaOH).
Xét phương trình hoá học của phản ứng sau: 4Al + 3O2 → 2Al2O3
a) Cho biết số nguyên tử, số phân tử của các chất tham gia phản ứng và các chất sản phẩm.
b) Cho biết tỉ lệ hệ số của các chất trong phương trình hoá học.