Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hoá học
Các câu hỏi tương tự
Cho hai phương trình nhiệt hóa học sau:
C(s) + H2O(g) \(\underrightarrow{t^o}\) CO(g) + H2(g) Δr\(H^0_{298}\) = +131,25 kJ (1)
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) Δr\(H^0_{298}\) = -231,04 kJ (2)
Trong hai phản ứng trên, phản ứng nào thu nhiệt, phản ứng nào tỏa nhiệt?
Cho hai phương trình nhiệt hóa học sau:
CO(g) + ½ O2(g) → CO2(g) Δr\(H^0_{298}\) = -283,00 kJ (1)
H2(g) + F2(g) → 2HF(g) Δr\(H^0_{298}\) = -546,00 kJ (2)
So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn?
Quan sát Hình 13.5, mô tả sơ đồ biểu diễn biến thiên enthalpy của phản ứng. Nhận xét về giá trị của Δf\(H^0_{298}\)(sp) so với Δf\(H^0_{298}\) (cđ).
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:N2(g) + O2(g) → 2NO(g) ΔrH^0_{298} +180 kJKết luận nào sau đây đúng?A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấpB. Phản ứng tỏa nhiệtC. Phản ứng xảy ra thuận lợi ở điều kiện thườngD. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đọc tiếp
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) Δr\(H^0_{298}\)= +180 kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
B. Phản ứng tỏa nhiệt
C. Phản ứng xảy ra thuận lợi ở điều kiện thường
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Hãy làm cho nhà em sạch bong với hỗn hợp baking soda (NaHCO3) và giấm (CH3COOH). Hỗn hợp này tạo ra một lượng lớn bọt. Phương trình nhiệt hóa học của phản ứng:NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) ΔrH^0_{298} 94,30 kJPhản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phản ứng trên
Đọc tiếp
Hãy làm cho nhà em sạch bong với hỗn hợp baking soda (NaHCO3) và giấm (CH3COOH). Hỗn hợp này tạo ra một lượng lớn bọt. Phương trình nhiệt hóa học của phản ứng:
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) Δr\(H^0_{298}\)= 94,30 kJ
Phản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phản ứng trên

Cho phương trình nhiệt hóa học sau:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) Δr\(H^0_{298}\)= -57,3 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Phương trình nhiệt hóa học cho biết thông tin gì về phản ứng hóa học.
Em hãy xác định enthalpy tạo thành theo đơn vị (kcal) của các chất sau: Fe2O3(s), NO(g), H2O(g), C2H5OH(l). Cho biết 1J = 0,239 cal.
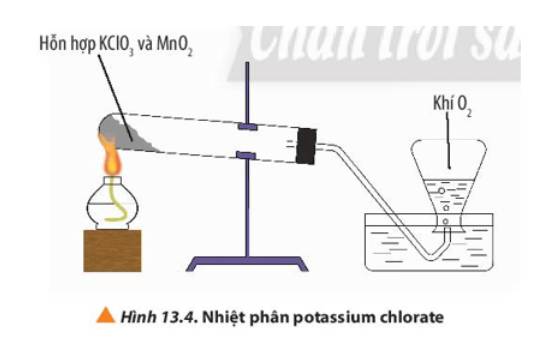
Thực hiện thí nghiệm 2. Nêu hiện tượng trước và sau khi đốt nóng hỗn hợp. Nếu ngừng đốt nóng thì phản ứng có xảy ra không?Thí nghiệm 2: Nhiệt phân potassium chlorateDụng cụ và thiết bị: Đèn cồn, ống nghiệm chịu nhiệt, nút cao su có gắn ống dẫn khí, chậu thủy tinh, bình tam giác, giá sắt.Hóa chất: Potassium chlorate (KClO3), manganese dioxide (MnO2)Tiến hành:Bước 1: Trộn đều khoảng 4 g tinh thể KClO3 đã được nghiền nhỏ với 1 g MnO2. Cho hỗn hợp vào ống nghiệm chịu nhiệt, khô. Đậy ống nghiệm vào n...
Đọc tiếp
Thực hiện thí nghiệm 2. Nêu hiện tượng trước và sau khi đốt nóng hỗn hợp. Nếu ngừng đốt nóng thì phản ứng có xảy ra không?
Thí nghiệm 2: Nhiệt phân potassium chlorate
Dụng cụ và thiết bị: Đèn cồn, ống nghiệm chịu nhiệt, nút cao su có gắn ống dẫn khí, chậu thủy tinh, bình tam giác, giá sắt.
Hóa chất: Potassium chlorate (KClO3), manganese dioxide (MnO2)
Tiến hành:
Bước 1: Trộn đều khoảng 4 g tinh thể KClO3 đã được nghiền nhỏ với 1 g MnO2. Cho hỗn hợp vào ống nghiệm chịu nhiệt, khô. Đậy ống nghiệm vào nút có gắn ống dẫn khí. Lắp hệ thống như Hình 13.4. Quan sát hiện tượng.
Bước 2: Dùng đèn cồn hơ nóng đều nửa đáy ống nghiệm, sau đó đun tập trung ở phần có chứa hóa chất. Quan sát hiện tượng.