Bài 42: Nồng độ dung dịch
Nội dung lý thuyết
Các phiên bản khácI. NỒNG ĐỘ PHẦN TRĂM CỦA DUNG DỊCH
Nồng độ phần trăm (kí hiệu là C%) của một dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch.
Công thức tính nồng độ phần trăm của dung dịch là:
.png)
Trong đó:
- mct là khối lượng chất tan, biểu thị bằng gam.
- mdd là khối lượng dung dịch, biểu thị bằng gam.
- Khối lượng dung dịch = khối lượng dung môi + khối lượng chất tan.
Ví dụ 1: Hòa tan 15 gam NaCl vào 45 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Ta có mdd = khối lượng dung môi + khối lượng chất tan
Chất tan ở đây là NaCl và dung môi là nước
=> mdd = 15 + 45 = 60 gam
Áp dụng công thức tính nồng độ phần trăm:
=> C% NaCl = \(\dfrac{m_{ct}}{m_{dd}}.100\%\) = \(\dfrac{15}{60}.100\%\) = 25%
Ví dụ 2: Một dung dịch H2SO4 có nồng độ 14%. Tính khối lượng H2SO4 có trong 150 gam dung dịch trên.
Áp dụng CT => mct = \(\dfrac{m_{dd}.C\%}{100\%}\)
<=> mH2SO4 = \(\dfrac{14.150\%}{100\%}\) = 21 gam
Ví dụ 3: Hòa tan 50 gam đường vào nước, dung dịch thu được có nồng độ 25%. Tính
a) Khối lượng dung dịch đường thu được.
b) Khối lượng nước cần cho sự pha chế.
Khối lượng dung dịch = \(\dfrac{100.50}{25}\) = 200 gam
Khối lượng nước cần để pha chế = 200 - 50 = 150 gam
@92372@@92373@@92375@
II. NỒNG ĐỘ MOL CỦA DUNG DỊCH
Nồng độ mol (kí hiệu là CM) của dung dịch cho biết số mol chất tan có trong một lít dung dịch.
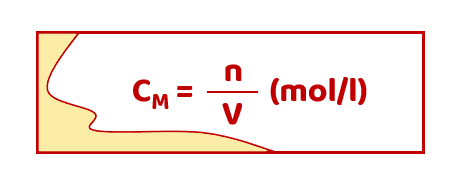
Trong đó:
- n là số mol chất tan.
- V là thể tích dung dịch, biểu thị bằng lít.
Ví dụ 1: Hòa tan 16 gam CuSO4 trong 200ml dung dịch. Tính nồng độ mol của dung dịch tạo thành.
nCuSO4 = \(\dfrac{16}{160}\)= 0,1 mol và 200ml = 0,2 lít
Áp dụng CT ta có CM = \(\dfrac{n}{V}\) = \(\dfrac{0,1}{0,2}\) = 0,5 (mol/l) hoặc 0,5(M)
Ví dụ 2: Trộn 2 lít dung dịch đường 0,5 M với 3 lít dung dịch đường 1M. Tính nồng độ mol của dung dịch thu được sau khi trộn.
Số mol đường có trong 2 lít dung dịch 1 có nồng độ 0,5M là n1 = 0,5 . 2 = 1 mol
Số mol đường có trong 3 lít dung dịch 1 có nồng độ 1M là n2 = 1 . 3 = 3 mol
Thể tích dung dịch thu được sau khi trộn: V = 2 + 3 = 5 lít.
Số mol đường có trong 5 lít dung dịch sau khi trộn: n = 1 + 3 = 4 mol
Nồng độ dung dịch thu được sau khi trộn: CM = \(\dfrac{3+1}{5}\) = 0,8 (M)
@92375@@92394@
III. TỔNG KẾT
1. Nồng độ phần trăm cho biết số gam chất tan có trong 100 gam dung dịch:
C% = \(\dfrac{m_{ct}}{m_{dd}}.100\%\)
2. Nồng độ mol cho biết số mol chất tan trong một lít dung dịch:
CM = \(\dfrac{n}{V}\) (mol/lít) hoặc (M)
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn
| quynhdovu2007 đã đóng góp một phiên bản khác cho bài học này (30 tháng 5 2021 lúc 9:12) | 1 lượt thích |