Bài 42. Luyện tập chương IV
Nội dung lý thuyết
I. KIẾN THỨC CẦN NHỚ
| Metan | Etilen | Axetilen | Benzen | |
| Công thức cấu tạo | ||||
 |  |  | 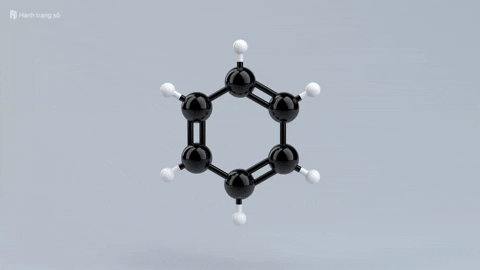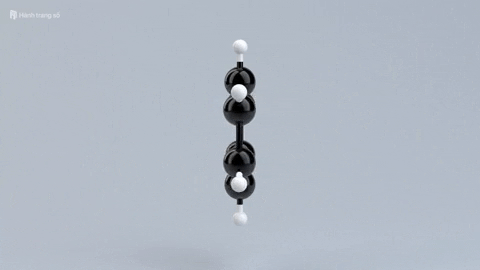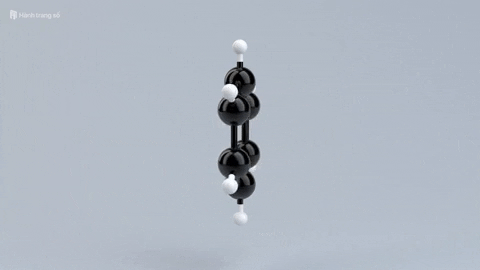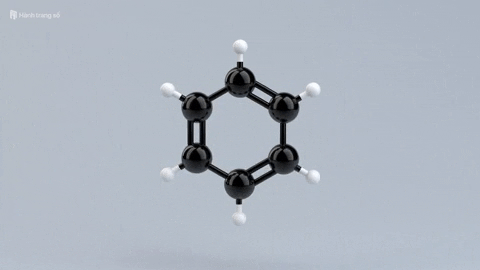 | |
| Đặc điểm cấu tạo phân tử | Phân tử chỉ gồm các liên kết đơn bền vững. | Có một liên kết đôi giữa C và C, gồm 1 liên kết kém bền và 1 liên kết bền. | Có một liên kết ba giữa C với C, gồm 2 liên kết kém bền và 1 liên kết bền. | Mạch vòng hình lục giác đều, có 3 liên kết đơn xen kẽ 3 liên kết đôi. |
| Phản ứng đặc trưng | Phản ứng thế. | Phản ứng cộng (làm mất màu dung dịch brom). | Phản ứng cộng (làm mất màu dung dịch brom). | Phản ứng thế với brom nguyên chất (lỏng). |
| Ứng dụng chính | Làm khí đốt để nấu ăn hoặc sưởi ấm. Điều chế bột than và nhiều chất khác. | Sản xuất axit axetic, rượu etylic,... Kích thích hoa quả mau chín. Điều chế các loại polime làm vật liệu. | Dùng làm đèn xì oxi - axetilen để hàn cắt kim loại. Nguyênliệu để sản xuất poli vinylclorua, cao su, axit axetic. | Nguyên liệu để sản xuất chất dẻo, phẩm nhuộm, thuốc trừ sâu, dược phẩm... Làm dung môi trong công nghiệp và trong phòng thí nghiệm. |
Phản ứng minh họa
| Metan | CH4 + Cl2 |
| Etilen | CH2=CH2 + Br2(dd) → CH2Br - CH2Br |
| Axetilen | CHΞCH + Br2(dd) → Br - CH=CH - Br Br - CH=CH - Br + Br2(dd) → CHBr2 - CHBr2 |
| Benzen | C6H6 + Br2 (nguyên chất) |
@687157@@687214@@687308@@687398@@687473@
II. LUYỆN TẬP
Bài 1. Có 3 bình không nhãn chứa lần lượt các khí sau: CH4, C2H4, CO2. Trình bày phương pháp hóa học để nhận biết ba khí trên. Viết phương trinh hóa học xảy ra nếu có.
Hướng dẫn giải
- Dùng dung dịch brom để nhận biết C2H4. Chất khí nào làm mất màu dung dịch brom là C2H4.
C2H4 + Br2 (nâu đỏ) → C2H4Br2 (không màu)
- Dùng nước vôi trong để phân biệt CO2 và CH4. Chất khí nào làm vẫn đục nước vôi trong là CO2, còn lại là CH4.
CO2 + Ca(OH)2 → CaCO3 + H2O
Bài 2. Đốt cháy hoàn toàn 4,48 lít khí C2H4 ở đktc.
a. Viết phương trình phản ứng xảy ra.
b. Tính khối lượng CO2 thu được sau phản ứng.
c. Dẫn toàn bộ lượng CO2 thu được đi qua dung dịch Ca(OH)2 dư, thu được m gam kết tủa. Tính giá trị của m.
Hướng dẫn giải
nC2H4 = \(\dfrac{4,48}{22,4}\) = 0,2 mol
a. C2H4 + 3O2 \(\underrightarrow{t^o}\) 2CO2 + 2H2O
b. Theo phương trình phản ứng ta có:
nCO2 = 2nC2H4 = 0,2.2 = 0,4 mol
<=> mCO2 = 0,4.44 = 17,6 gam
c. Khi cho CO2 đi qua dung dịch Ca(OH)2 dư thì xảy ra phản ứng sau:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Ta thấy nCaCO3↓ = nCO2 = 0,4 mol
=> mCaCO3↓ = 0,4.100 = 40 gam.
Bài 3. Hiđrocacbon A, B mạch hở có tỉ khối đối với H2 tương ứng lần lượt là 22 và 13.
a. Xác định công thức phân tử và công thức cấu tạo của A, B.
b. Dẫn 5,6 lít hỗn hợp A, B có tỉ khối đối với H2 là 18,4 qua dung dịch nước brom dư sao cho phản ứng xảy ra hoàn toàn. Hãy tính khối lượng brom đã tham gia phản ứng (biết thể tích khí đo ở đktc).
Hướng dẫn giải
a. Ta có MA = 22 x 2 = 44 g/mol. MB = 13x2 = 26 g/mol.
Gọi công thức của A là CxHy => 12x + y = 44. Thử các giá trị nguyên dương của x và y => x = 3; y = 8
=> Công thức của A là C3H8. Công thức cấu tạo của A là CH3-CH2-CH3.
Tương tự ta có công thúc của B là C2H2
=> Công thức cấu tạo của B là CH≡CH
b. Gọi số mol của C2H2 có trong hỗn hợp là x → nC3H8 = \(\dfrac{5,6}{22,4}\) - x (mol).
Tỉ khối của hỗn hợp đối với H2 là 18,4 => \(\dfrac{26x+44\left(0,25-x\right)}{0,25}\) = 18,4 x 2 => x = 0,1 mol.
Chỉ có C2H2 phản ứng với dung dịch brom dư theo phản ứng:
C2H2 + 2Br2 → C2H2Br4
=> nBr2 phản ứng = 2nC2H2 = 0,2 mol
<=> mBr2 phản ứng = 0,2 x 160 = 32 gam.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!