Bài 36. Mêtan
Nội dung lý thuyết
Trong công nghiệp và đời sống, con người không thể thiếu các nguồn nguyên liệu cho các quá trình sản xuất và sinh hoạt. Và Metan là một trong số những loại nguyên liệu đó, vậy metan có cấu tạo, tính chất và ứng dụng như nào trong thực tế? Chúng ta cùng tìm hiểu qua bài học sau.
- Công thức phân tử: CH4
- Phân tử khối: 16
I. TRẠNG THÁI TỰ NHIÊN, TÍNH CHẤT VẬT LÍ
Trong tự nhiên, metan có nhiều trong các mỏ khí (khí thiên nhiên), trong mỏ dầu (khí đồng hành), trong các mỏ than (khí mỏ than), trong bùn ao (khí bùn ao), khí biogas. Khí metan được sinh ra trong điều kiện các chất hữu cơ bị vi sinh vật phân hủy trong điều kiện hiếm khí. (có rất ít khí oxi).
Metan là chất khí, không màu, không mùi, nhẹ hơn không khí (d = \(\dfrac{16}{29}\)) và tan rất ít trong nước.

Hình 1: Một số nguồn metan trong tự nhiên
@728009@
II. CẤU TẠO PHÂN TỬ
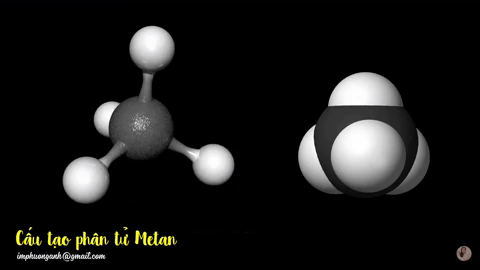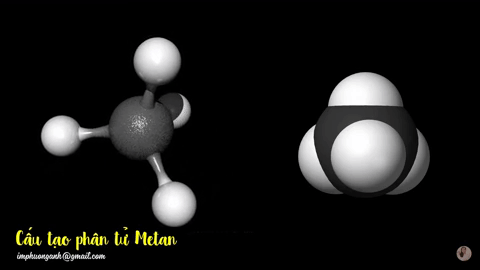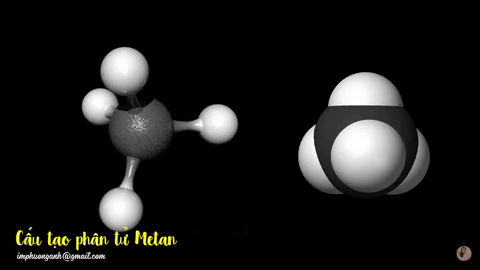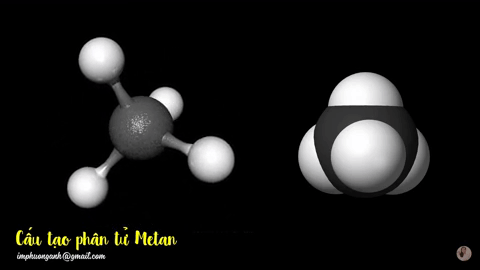
Hình 2: Mô hình phân tử metan
dạng rỗng và dạng đặc.
Phân tử metan (CH4) gồm một nguyên tử cacbon liên kết với bốn nguyên tử hidro bằng bốn liên kết đơn, công thức cấu tạo của metan:
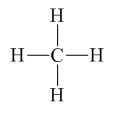
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
Tiến hành thí nghiệm đốt cháy khí metan trong không khí.

Hình 3: Sơ đồ thí nghiệm đốt cháy khí metan.
Hiện tượng:
Sau khi đốt, có các giọt nước nhỏ bám trên thành ống nghiệm.
Đổ dung dịch nước vôi trong vào ống nghiệm sau khi đốt thấy dung dịch xuất hiện vẩn đục màu trắng.
Ống nghiệm nóng lên.
Kết luận:
Khí metan cháy tạo thành khí cacbonic , hơi nước và phản ứng tỏa nhiều nhiệt.
Phương trình hóa học: CH4(k) + 2O2(k)
CO2(k) + 2H2O(h)
Chú ý: Hỗn hợp một thể tích khí metan và hai thể tích khí oxi là hỗn hợp gây nổ mạnh.

Hình 4: Hình ảnh vụ nổ ở trong hầm khai thác than và trong lòng cống thoát nước do tích tụ nhiều khí metan.
2. Tác dụng với clo khi có ánh sáng
Tiến hành thí nghiệm cho hỗn hợp khí metan và clo phản ứng với nhau trong bình kín, trong suốt dưới điều kiện có chiếu sáng.
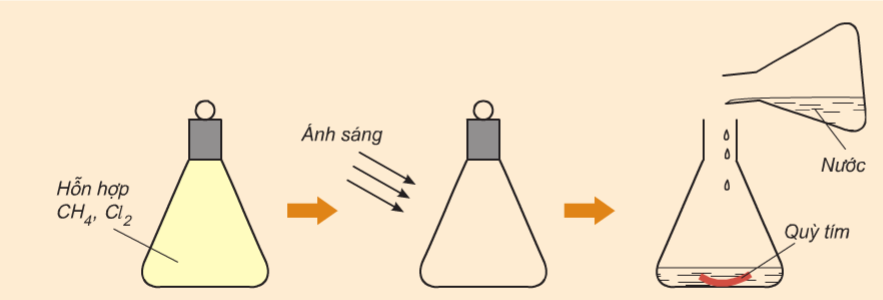
Hình 5: Thí nghiệm metan phản ứng với clo khi có ánh sáng.
Hiện tượng:
Ban đầu hỗn hợp khí có màu vàng của clo, sau một thời gian thì màu vàng nhạt dần rồi mất đi, thêm nước rồi nhúng quỳ tím vào bình thấy quỳ tím chuyển sang màu đỏ.
Kết luận:
Metan đã phản ứng với clo khi có ánh sáng, sản phẩm thu được sau phản ứng có tính axit nên khi cho quỳ tím ẩm vào thì quỳ tím chuyển đỏ.
Phương trình hóa học: CH4 + Cl2 → HCl + CH3Cl (clo metan)
Ở phản ứng này, nguyên tử hidro của metan được thay thế bởi nguyên tử clo, vì vậy được gọi là phản ứng thế. Nếu dùng dư khí clo, toàn bộ nguyên tử hidro có trong phân tử metan có thể bị thay thế hết bởi nguyên tử clo.
.gif)
@727930@@728072@@728153@
IV. ỨNG DỤNG
Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và sản xuất như dùng làm khí đốt để nấu ăn hay sưởi ấm.
Trong công nghiệp metan là nguyên liệu dùng điều chế hiđro và nhiều loại hợp chất hữu cơ quan trọng khác như metanol, axit axetic ...
CH4(k) + H2O \(\underrightarrow{xt,t^o}\) CO2(k) + H2(k)
Ngoài ra metan còn được dùng để điều chế bột than và nhiều chất khác.

Hình 6: Một số ứng dụng của metan trong thực tế.
V. TỔNG KẾT
1. Metan là chất khí, không màu, không mùi, ít tan trong nước.
2. Công thức cấu tạo của metan là:
3. Metan có những tính chất hóa học sau: tham gia phản ứng cháy, phản ứng thế với clo.
4. Metan là nguyên liệu, nhiên liệu trong đời sống và công nghiệp.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!