Bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại
Nội dung lý thuyết
I. Kim loại trong tự nhiên
- Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối,...) trong quặng, chỉ một số kim loại kém hoạt động như bạc, vàng, platinum,... được tìm thấy dưới dạng đơn chất.
- Quặng là những loại đất, đá tồn tại trong tự nhiên có chứa khoáng vật của kim loại hoặc hợp chất kim loại với trữ lượng đủ lớn để có thể khai thác. Quặng thường chứa tạp chất. Phương pháp được sử dụng để tách một kim loại nhất định từ quặng của nó phụ thuộc vào tính chất của kim loại và của quặng.




- Một số loại quặng kim loại thông dụng:
| Kim loại | Quặng | Thành phần chính |
| Nhôm (Al) | Bauxite | Al2O3.2H2O |
| Kẽm (Zn) | Zinc blende | ZnS |
| Sắt (Fe) | Hematite | Fe2O3 |
| Pyrite | FeS2 | |
| Đồng (Cu) | Chalcopyrite | CuFeS2 |
II. Các phương pháp tách kim loại
1. Nguyên tắc
Khử ion kim loại thành nguyên tử: Mn+ + ne → M.
2. Tách kim loại hoạt động hóa học mạnh – điện phân nóng chảy
Những kim loại hoạt động hóa học mạnh như K, Na, Ca, Mg, Al,... được điều chế bằng phương pháp điện phân nóng chảy các hợp chất (oxide, muối chloride) của chúng.
a) Điện phân oxide nóng chảy
Trong công nghiệp, nhôm được sản xuất từ quặng bauxite theo hai giai đoạn chính:
- Giai đoạn 1: Tinh chế quặng bauxite bằng phương pháp hóa học thu được Al2O3.
- Giai đoạn 2: Điện phân Al2O3 và cryolite nóng chảy.
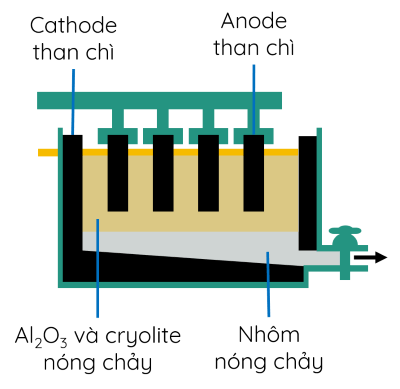
b) Điện phân muối chloride nóng chảy
Để điều chế các kim loại như K, Na, Ca, Mg,... người ta điện phân muối chloride của chúng ở trạng thái nóng chảy.
Ví dụ: Điện phân MgCl2 nóng chảy.
MgCl2(l) \(\underrightarrow{\text{đpnc}}\) Mg(l) + Cl2(g).
3. Tách kim loại hoạt động trung bình, yếu
a) Phương pháp nhiệt luyện
- Nguyên tắc: Khử các oxide kim loại ở nhiệt độ cao bằng các chất khử như C, CO,...
- Dùng để điều chế các kim loại có độ hoạt động hóa học trung bình, yếu như Zn, Fe, Sn, Pb, Cu,...
Ví dụ: Tách kẽm từ quặng zinc blende
+ Đốt quặng zinc blende: 2ZnS (s) + 3O2(g) \(\underrightarrow{t^o}\) 2ZnO(s) + 2SO2(g)
+ Khử zinc oxide ở nhiệt độ cao bằng than cốc: ZnO(s) + C(s) \(\underrightarrow{t^o}\) Zn(g) + CO(g)
b) Phương pháp điện phân dung dịch
Kim loại hoạt động trung bình, yếu có thể được điều chế bằng cách điện phân dung dịch muối của chúng.
Ví dụ: Điện phân dung dịch CuCl2 để điều chế Cu.
CuCl2(aq) \(\underrightarrow{\text{đpdd}}\) Cu(s) + Cl2(g)
c) Phương pháp thủy luyện
Cơ sở: Dùng những dung dịch thích hợp (như H2SO4, NaOH, NaCN,...) để hòa tan kim loại hoặc hợp chất của chúng, tách phần không tan ra khỏi dung dịch. Sau đó khử những ion kim loại này trong dung dịch bằng kim loại có tính khử mạnh hơn như Fe, Zn,...
Ví dụ: Dùng Fe để khử ion Cu2+ trong dung dịch muối đồng
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
III. Tái chế kim loại
- Tái chế kim loại giúp tiết kiệm năng lượng so với sản xuất kim loại từ quặng, giảm thiểu một số tác động tiêu cực tới môi trường, gia tăng giá trị kinh tế, thực hiện mục tiêu phát triển bền vững.
- Quy trình tái chế kim loại: thu gom, phân loại xử lí sơ bộ phối trộn phế liệu nấu chảy tinh chế đúc chế tạo gia công.
- Nhôm, sắt, đồng là những kim loại được tái chế hiệu quả nhất, có thể tái chế nhiều lần mà không bị tiêu hao. Nhôm, sắt, đồng tái chế được sử dụng trong nhiều lĩnh vực như xây dựng, phương tiện giao thông, thiết bị điện tử, dây dẫn điện, nhạc cụ,...


