Bài 19: Tính chất vật lí và tính chất hóa học của kim loại
Nội dung lý thuyết
I. Tính chất vật lí
Ở điều kiện thường, các kim loại đều có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
1. Tính dẻo
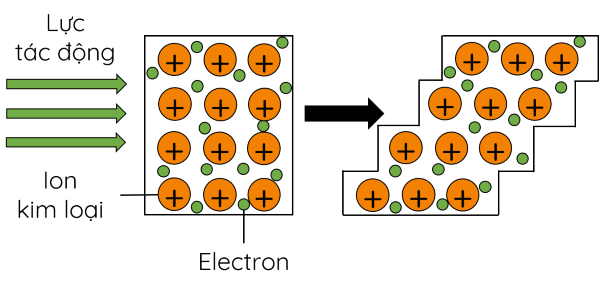
- Kim loại có tính dẻo: dễ rèn, dễ dát mỏng và dễ kéo sợi. Những kim loại có tính dẻo cao: Au, Ag, Al, Cu, Sn,... Người ta có thể dát được những lá vàng mỏng tới khoảng 8 nm.
- Nguyên nhân: các electron tự do trong mạng tinh thể kim loại chuyển động, liên kết các ion kim loại lại với nhau nên khi thanh kim loại chịu lực tác động, các ion dương kim loại trong mạng tinh thể kim loại có thể trượt lên nhau mà không tách rời nhau.
2. Tính dẫn điện
- Tất cả các kim loại đều có tính dẫn điện.
- Nguyên nhân: khi một hiệu điện thế được áp vào thanh kim loại, các electron tự do trong mạng tinh thể sẽ di chuyển từ phía cực âm về phía cực dương thanh kim loại trở thành vật dẫn điện.
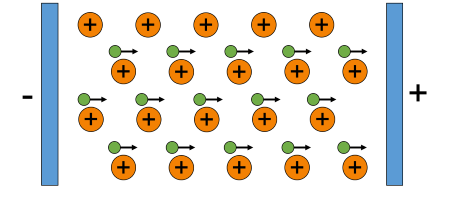
- Kim loại dẫn điện tốt nhất là bạc (Ag), tiếp sau là đồng (Cu), vàng (Au), nhôm (Al),... Trong đó, đồng được sử dụng làm dây dẫn điện.

3. Tính dẫn nhiệt
- Nguyên nhân: đốt nóng một đầu của thanh kim loại động năng của các electron trong vùng đó tăng lên truyền động năng cho các ion dương ở các nút mạng và các electron khác trong toàn thanh kim loại thông qua va chạm nhiệt được lan truyền trong toàn bộ thanh kim loại.
- Các kim loại dẫn điện tốt thường dẫn nhiệt tốt.
- Ứng dụng: làm dụng cụ nấu ăn.

4. Tính ánh kim
- Kim loại có vẻ sáng lấp lánh, gọi là “ánh kim”. Do đó, một số kim loại được dùng làm đồ trang sức hoặc vật trang trí.

- Nguyên nhân: các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được.
- Trên thực tế, khi nhìn vào nhiều kim loại không thấy ánh kim vì chúng thường bị bao phủ bởi một lớp oxide, ví dụ như sắt thường có gỉ sắt, nhôm bị phủ lớp aluminium oxide,...

5. Một số tính chất vật lí khác của kim loại
a) Khối lượng riêng
- Khối lượng riêng của các kim loại rất khác nhau, kim loại nhẹ nhất là lithium (D = 0,534 g/cm3), kim loại nặng nhất là osmium (D = 22,6 g/cm3).
- Kim loại có D < 5 g/cm3 là kim loại nhẹ, kim loại có D > 5 g/cm3 là kim loại nặng.
b) Nhiệt độ nóng chảy
- Nhiệt độ nóng chảy của các kim loại biến đổi trong khoảng rộng.
+ Kim loại có nhiệt độ nóng chảy cao nhất là tungsen (vonfram, W): 3410oC, dùng làm dây tóc bóng đèn.

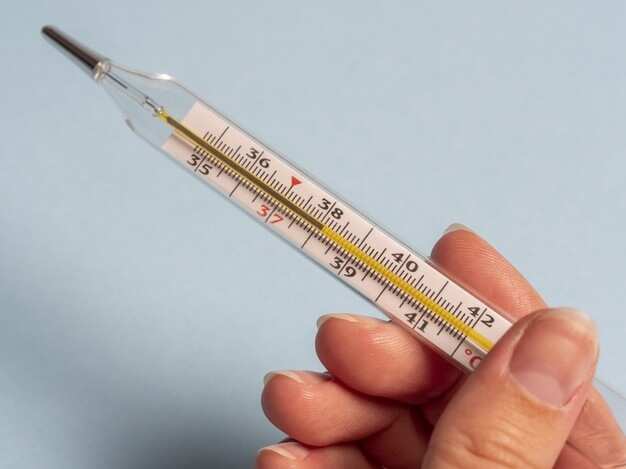
+ Kim loại có nhiệt độ nóng chảy thấp nhất là thủy ngân (Hg): -39oC ở điều kiện thường, thủy ngân ở trạng thái lỏng, dùng trong nhiệt kế.
c) Tính cứng
Các kim loại có độ cứng rất khác nhau.
- Kim loại cứng nhất là chromium, cắt được kính.
- Kim loại mềm nhất là các kim loại kiềm, có thể cắt dễ dàng bằng dao.
II. Tính chất hóa học
Tính chất hóa học chung của kim loại là tính khử: M → Mn+ + ne.
1. Tác dụng với phi kim
Hầu hết các kim loại đều phản ứng với các phi kim điển hình.
a) Tác dụng với oxygen
Hầu hết các kim loại (trừ bạc, vàng, platin,...) đều tác dụng với oxygen tạo thanh oxide.
Ví dụ: Khi đốt nóng, bột nhôm cháy mạnh trong không khí tạo thành aluminium oxide:
4Al(s) + 3O2(g) \(\underrightarrow{t^o}\) 2Al2O3(s)
b) Tác dụng với chlorine
Hầu hết các kim loại đều tác dụng với khí chlorine khi đun nóng, thu được muối chloride.
Ví dụ: Dây sắt nóng đỏ cháy mạnh trong khí chlorine tạo ra khói màu nâu có chứa iron(III) chloride:
2Fe(s) + 3Cl2(g) \(\underrightarrow{t^o}\) 2FeCl3(s)
c) Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh khi đun nóng (trừ thủy ngân phản ứng ngay ở nhiệt độ thường).
Ví dụ:
Fe(s) + S(s) \(\underrightarrow{t^o}\) FeS(s)
Hg(l) + S(s) → HgS(s)
2. Tác dụng với nước
Hầu hết các kim loại nhóm IA, IIA có tính khử mạnh, tác dụng với nước ở nhiệt độ thường, giải phóng H2.
Ví dụ:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Những kim loại có thế điện cực chuẩn nhỏ hơn -0,414 V có thể đẩy được hydrogen ra khỏi nước.
3. Tác dụng với dung dịch acid
a) Với dung dịch HCl, H2SO4 loãng
Ở điều kiện chuẩn, những kim loại có thế điện cực chuẩn nhỏ hơn 0 có thể tác dụng với các dung dịch acid (như HCl, H2SO4 loãng) tạo thành H2.
Ví dụ: Sắt phản ứng với dung dịch H2SO4 loãng theo phương trình hóa học sau:
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g)
b) Với dung dịch H2SO4 đặc
- Hầu hết kim loại (trừ Pt, Au) khử được \(\overset{+6}{S}\) (trong H2SO4 đặc) xuống số oxi hóa thấp hơn.
Ví dụ: Cu(s) + 2H2SO4(đặc) → CuSO4(aq) + SO2(g) + 2H2O(l)
Chú ý: HNO3 đặc, nguội và H2SO4 đặc, nguội làm thụ động hóa Al, Fe, Cr,...
4. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối của nó.
Ví dụ:
Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag(s)