Bài 16: Luyện tập liên kết hóa học
Nội dung lý thuyết
A. KIẾN THỨC CẦN NẮM
1. So sánh liên kết ion và liên kết cộng hóa trị
| Liên kết | Liên kết ion | Liên kết cộng hóa trị | |
| Không cực | Có cực | ||
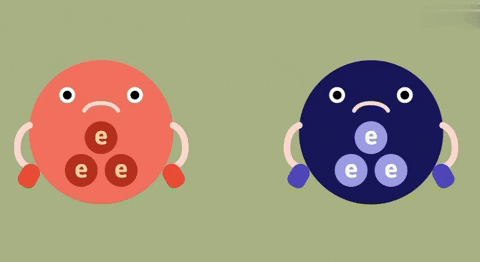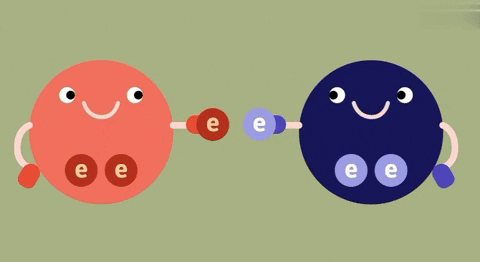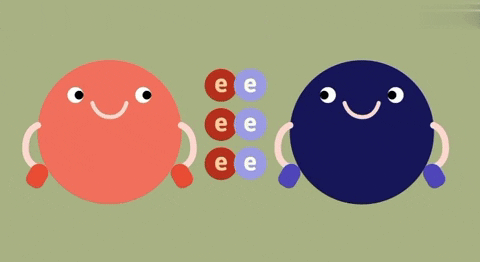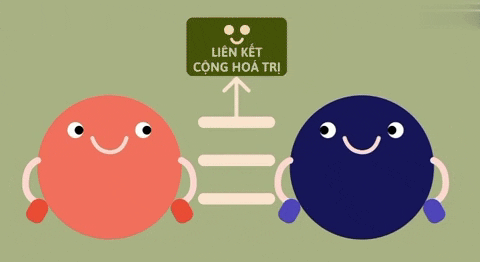
| Định nghĩa | Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. | Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
| |
| Bản chất của liên kết | Electron chuyển từ nguyên tử này sang nguyên tử kia. | Đôi electron chung không lệch về phía nào. | Đôi electron chung lệch về nguyên tử nào có độ âm lớn hơn. |
| Hiệu độ âm điện | ≥ 1,7 | 0 ➜ < 0,4 | 0,4 ➜ < 1,7 |
| Đặc tính | Bền | Bền | |
2. So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử
| Khái niệm | Tinh thể ion | Tinh thể nguyên tử | Tinh thể phân tử |
Các cation và anion được phân bố luân phiên và đều đặn ở các điểm nút của mạng tinh thể ion. NaCl | Ở những điểm nút của mạng tinh thể nguyên tử là những nguyên tử.
Than chì | Ở những điểm nút của mạng tinh thể phân tử là những phân tử. | |
| Lực liên kết | Các ion mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện. Lực này lớn. | Các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. Lực này rất lớn. | Các phân tử liên kết với nhau bằng lực hút giữa các phân tử, yếu hơn lực hút giữa các các ion và lực liên kết cộng hóa trị. |
| Đặc tính | Bền, khá rắn, khó bay hơi, khó nóng chảy. | Bền, khá cứng, khó nóng chảy và bay hơi. | Không bền, dễ nóng chảy, dễ bay hơi. |
B. BÀI TẬP
Bài 1. Hãy tính số oxi hoá của crom (Cr) trong hợp chất K2Cr2O7.
Gọi x là số oxi hoá của Cr. Vì trong một phân tử trung hoà, tổng đại số các số oxi hoá của các nguyên tử bằng không nên ta có:
2.(+1) + 2.X + 7.(-2) = 0
⇔ 2x = +14 - 2 = +12
⇔ x = +6
Vậy số oxi hoá của Cr trong K2Cr2O7 bằng +6.
Bài 2. Hãy viết công thức cấu tạo của các phân tử: N2, CH4, NH3, H2O. Dựa vào quy tắc biến thiên độ âm điện của các nguyên tố trong một chu kì, hãy cho biết trong các phân tử nói trên, phân tử nào có liên kết không phân cực, phân tử nào có liên kết phân cực mạnh nhất.
Lời giải
Các liên kết trong phân tử N2 là các liên kết cộng hoá trị điển hình, không phân cực vì đó là những liên kết giữa hai nguyên tử giống nhau (hiệu độ im điện bằng không).
Các liên kết trong các phân tử còn lại là các liên kết giữa các nguyên tử trong cùng một chu kì (C, N, O) và nguyên tử H (độ âm điện bằng 2,20). Vì trong cùng một chu kì, độ âm điện tăng dần từ trái sang phải nên so với H, hiệu độ âm điện cũng tăng theo, do đó các liên kết trong phân tử H2O là các liên kết phân cực mạnh nhất.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!