Bài 16: Hợp chất của cacbon
Nội dung lý thuyết
A. CACBON MONOOXIT (CO)
I. TÍNH CHẤT VẬT LÍ
- Cacbon monooxit (CO) là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, rất ít tan trong nước, hóa lỏng ở -191,5oC, hóa rắn ở -205,2oC, rất bền với nhiệt.
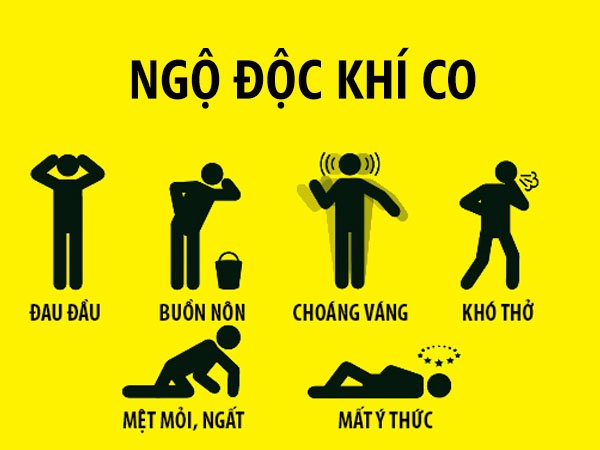
- Khí CO rất độc, gây ảnh hưởng nghiêm trọng đến quá trình hô hấp của con người, nếu hít phải 1 lượng đủ lớn có thể dẫn đến tử vong.
II. TÍNH CHẤT HÓA HỌC
1. Cacbon monooxit là oxit trung tính (oxit không tạo muối)
CO không tác dụng với nước, axit và dung dịch kiềm ở điều kiện thường.
2. Tính khử
Khi đốt nóng, khí CO cháy trong oxi hoặc không khí, cho ngọn lửa màu lam nhạt và tỏa nhiều nhiệt:
2CO + O2 \(\underrightarrow{t^o}\) 2CO2
Vì tính chất này mà CO được sử dụng để làm nhiên liệu.
Thí nghiệm điều chế và đốt cháy khí CO.
Ngoài ra, ở nhiệt độ cao CO còn khử được nhiều oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học.
Fe2O3 + 3CO \(\underrightarrow{t^o}\) 2Fe + 3CO2
Tình chất này được dùng trong luyện kim để khử các oxit kim loại từ đó điều chế được các kim loại tương ứng.
@1466146@@1466235@
III. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Khí CO được điều chế bằng cách đun nóng axit fomic HCOOH khi có mặt H2SO4 đặc.
HCOOH \(\underrightarrow{H_2SO_4đ,t^o}\) CO + H2O
2. Trong công nghiệp
Khí CO thường được sản xuất bằng cách cho hơi nước đi qua than nung đỏ:
C + H2O CO + H2
Hỗn hợp khí tạo thành được gọi là khí than ướt, chứa khoảng 44% CO, còn lại là các khí khác như CO2, H2, N2...
Khí CO còn được sản xuất trong các lò gas bằng cách thổi không khí qua than nung đỏ. Ở phần dưới của lò, cacbon cháy thành cacbon đioxit. Khi đi qua lớp than nung đỏ, CO2 bị khử thành khí CO:
CO2 + C \(\underrightarrow{t^o}\) 2CO
Hỗn hợp khí thu được gọi là khí lò gas (khí than khô). Trong khí lò gas, CO thường chiếm 25%, còn lại là N2, CO2 và một lượng nhỏ các khí khác.
Khí than ướt, khí lò gas đều được dùng làm nhiên liệu khí.
B. CACBON ĐIOXIT (CO2)
I. TÍNH CHẤT VẬT LÍ
- Là chất khí không màu, nặng gấp 1,5 lần không khí, tan không nhiều trong nước.
- Ở nhiệt độ thường, dưới áp suất 60 atm, khí CO2 sẽ hóa thành chất lỏng không màu, linh động.
- Ở trạng thái rắn, CO2 tạo thành một khối trắng, gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa, dùng để tạo môi trường lạnh không có hơi ẩm.
@1466059@
II. TÍNH CHẤT HÓA HỌC
- Khí CO2 không cháy và không duy trì sự cháy của nhiều chất, nên người ta thường dùng những bình tạo khí CO2 để dập các đám cháy.

Lưu ý: Không được dùng khí CO2 để dập tắt các đám cháy kim loại như Mg, Al vì các kim loại này có tính khử mạnh có thể phản ứng với khí CO2 sinh ra cacbon làm cho đám cháy càng lớn hơn do có thêm chất cháy là cacbon.
- CO2 là oxit axit, khi tan trong nước tạo thành dung dịch axit cacbonic:
CO2 + H2O ⇌ H2CO3
- Tác dụng với dung dịch bazơ:
CO2 + Ca(OH)2 → CaCO3 + H2O
2CO2 + Ca(OH)2 → Ca(HCO3)2
Phản ứng tạo kết tủa giữa khí CO2 dung dịch Ca(OH)2
@1466297@
III. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
CO2 được điều chế trong phòng thí nghiệm bằng cách cho dung dịch HCl tác dụng với đá vôi:
2HCl + CaCO3 → CaCl2 + CO2 + H2O
2. Trong công nghiệp
Khí CO2 được thu hồi từ các quá trình như đốt cháy than, chuyển hóa khí thiên nhiên, dầu mỏ,...; quá trình nung vôi; quá trình lên men rượu từ glucozơ.
C. AXIT CACBONIC VÀ MUỐI CACBONAT
I. AXIT CACBONIC (H2CO3)
Axit cacbonic H2CO3 rất kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O. Trong dung dịch phân li hai nấc, chủ yếu thành các ion H+ và HCO3- và chỉ tạo 1 lượng rất nhỏ CO32-.
H2CO3 ⇌ H+ + HCO3-
HCO3- ⇌ H+ + CO32-
Axit cacbonic tạo hai muối:
- Muối cacbonat chứa ion CO32-.
- Muối hidrocacbonat chứa ion HCO3-.
II. MUỐI CACBONAT
1. Tính chất
a. Tính tan
| Tan được trong nước | Không tan trong nước |
| Các muối cacbonat của kim loại kiềm và đa số muối hidrocacbonat. | Các cacbonat không phải của kim loại kiềm. |
b. Tác dụng với axit
Muối cacbonat, hidrocacbonat dễ dàng tác dụng với dung dịch axit sinh ra khí CO2.
NaHCO3 + HCl → NaCl + CO2 + H2O
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
Phương trình ion rút gọn:
HCO3- + H+ → CO2 + H2O
CO32- + 2H+ → CO2 + H2O
c. Tác dụng với dung dịch kiềm
Các muối hidrocacbonat dễ dàng tác dụng được với dung dịch kiềm còn muối cacbonat thì không.
2NaHCO3 + Ca(OH)2 → CaCO3 + Na2CO3 + 2H2O
HCO3- + OH- → CO32- + H2O
d. Phản ứng nhiệt phân
- Tất cả các muối hidrocacbonat đều bị nhiệt phân hủy.
- Muối cacbonat của kim loại kiềm không bị nhiệt phân, còn muối cacbonat của các kim loại khác bị nhiệt phân hủy.
MgCO3 \(\underrightarrow{t^o}\) MgO + CO2
2NaHCO3 \(\underrightarrow{t^o}\) Na2CO3 + CO2 + H2O
@1466378@@1466467@
2. Ứng dụng
- Canxi cacbonat CaCO3 tinh khiết là chất bột màu trắng, nhẹ, được dùng làm chất độn trong 1 số ngành công nghiệp.
- Natri cacbonat khan (sođa khan) Na2CO3 được dùng trong công nghiệp thủy tinh, đồ gốm, bột giặt,...
- Natri hidrocacbonat NaHCO3 được dùng trong công nghiệp thực phẩm, làm thuốc giảm đau dạ dày do thừa axit.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!