Bài 15: Cacbon
Nội dung lý thuyết
I. VỊ TRÍ VÀ CẤU HÌNH ELECTRON NGUYÊN TỬ
- C (Z=6): 1s22s22p2.
- Nằm ở ô thứ 6, chu kì 2, nhóm IVA của bảng tuần hoàn.
- Lớp ngoài cùng của C có 4 electron nên trong các hợp chất nguyên tử cacbon có thể tạo được tối đa 4 liên kết cộng hóa trị với các nguyên tử khác.
- Các số oxi hóa của cacbon là -4, 0, +2 và +4.
@1460094@
II. TÍNH CHÁT VẬT LÍ
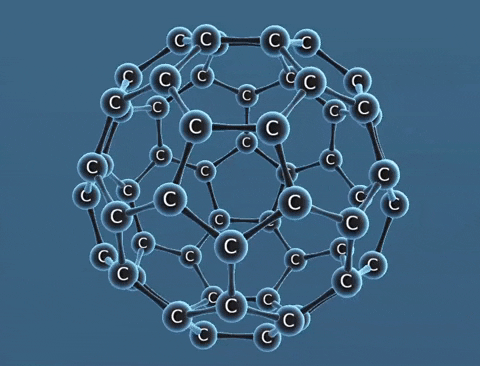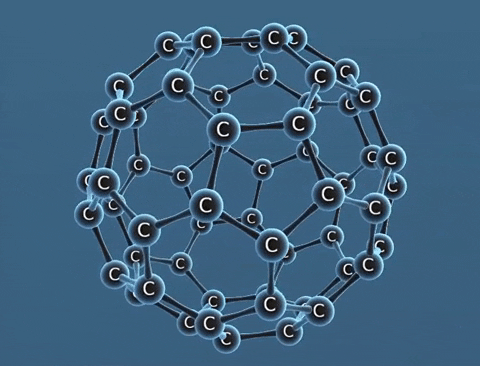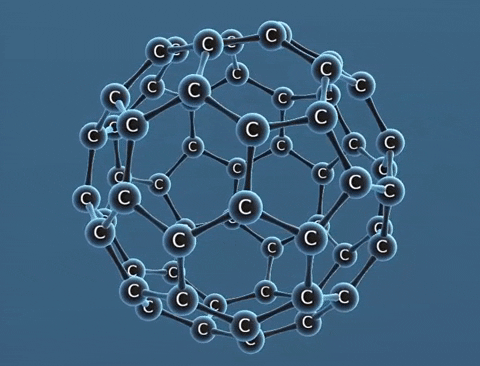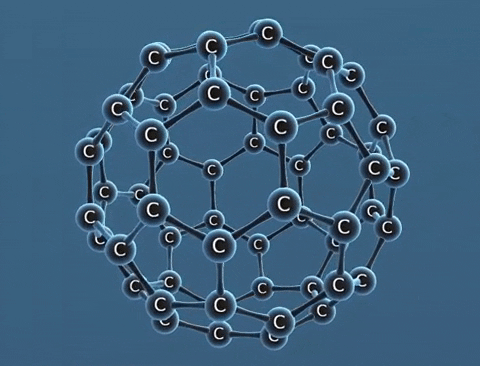
Nguyên tố cacbon có một số dạng thù hình là than chì, kim cương, fuleren,... Chúng khác nhau về tính chất vật lí.
| Kim cương | Than chì | Fuleren | |
| Tính chất vật lí | Là tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. | Là chất tinh thể màu xám đen. | Gồm các phân tử C60, C70... Phân tử C60 có cấu trúc hình rỗng, gồm 32 mặt với 60 đỉnh là 60 nguyên tử cacbon. |
| Cấu tạo | 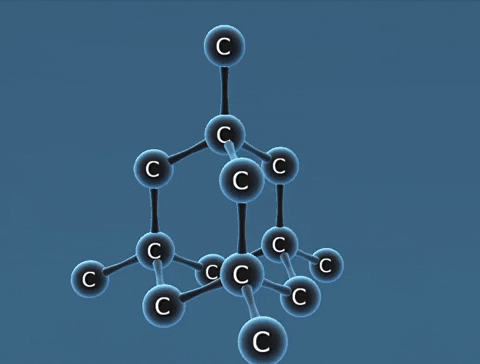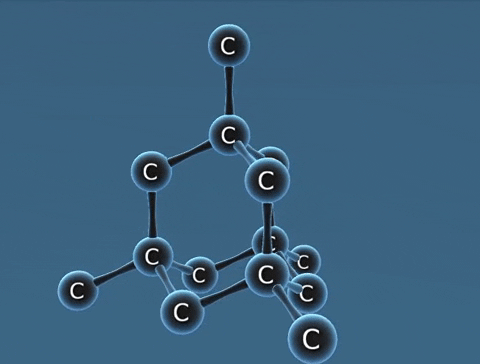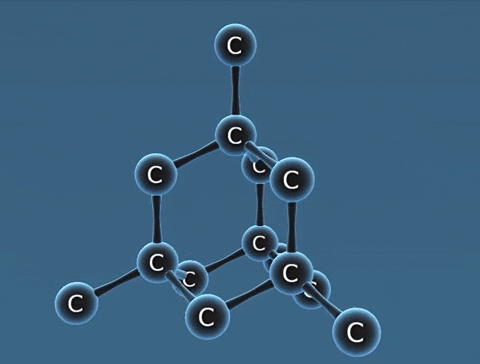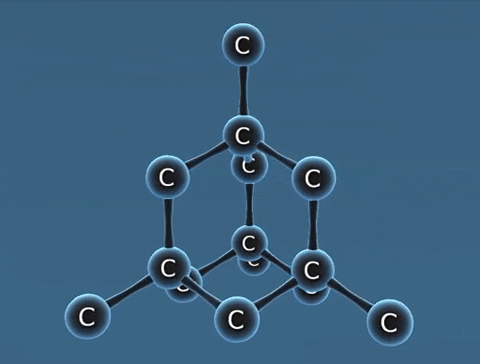 | 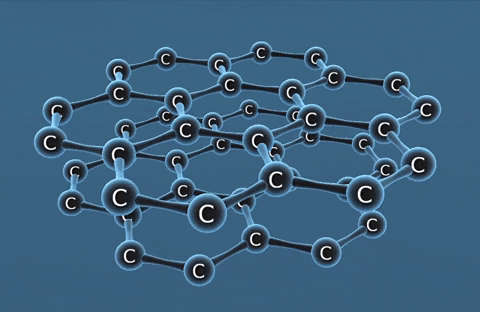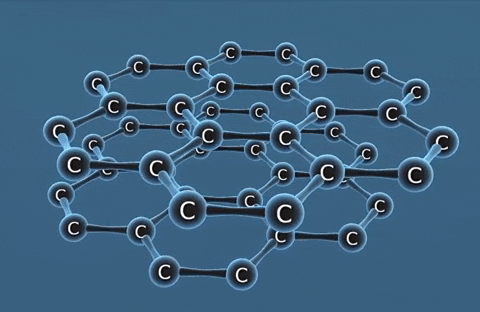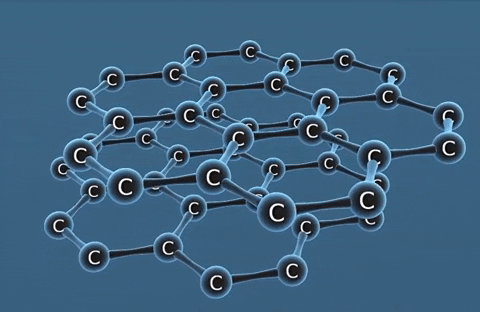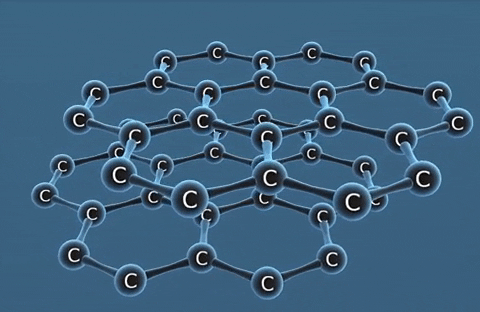 |
|
Các loại than điều chế nhân tạo như than gỗ, than xương, than muội,... được gọi chung là cacbon vô định hình. Than gỗ, than xương có cấu tạo xốp nên chúng có khả năng hấp phụ mạnh các chất khí và chất tan trong dung dịch.
@1460192@
III. TÍNH CHẤT HÓA HỌC
Trong các phản ứng oxi hóa khử, đơn chất cacbon có thể tăng hoặc giảm số oxi hóa, nên nó có thể hiện tính khử hoặc tính oxi hóa. Tuy nhiên tính chất chủ yếu của cacbon vẫn là tính khử.
1. Tính khử
a. Tác dụng với oxi
Cacbon cháy trong không khí, phản ứng tỏa nhiều nhiệt:
C + O2 \(\underrightarrow{t^o}\) CO2
Ở nhiệt độ cao C lại khử được CO2 vừa sinh ra theo phản ứng:
C + CO2 \(\underrightarrow{t^o}\) 2CO
b. Tác dụng với hợp chất
Ở nhiệt độ cao, cacbon có thể khử được nhiều oxit kim loại đứng sau nhôm trong dãy hoạt động hóa học, phản ứng được với nhiều chất oxi hóa khác nhau như HNO3, H2SO4 đặc, KClO3,...
C + 2CuO \(\underrightarrow{t^o}\) 2Cu + CO2
C + 4HNO3 đặc \(\underrightarrow{t^o}\) CO2 + 4NO2 + 2H2O
2. Tính oxi hóa
a. Tác dụng với hidro
Ở nhiệt độ cao và có mặt chất xúc tác, C tác dụng với H2 tạo thành khí CH4:
C + 2H2 \(\underrightarrow{xt,t^o}\) CH4
b. Tác dụng với kim loại
Ở nhiệt độ cao, C tác dụng với một số kim loại tạo thành cacbua kim loại.
4Al + 3C \(\underrightarrow{t^o}\) Al4C3 (nhôm cacbua)
Ca + 2C \(\underrightarrow{t^o}\) CaC2 (canxi cacbua)
@1460255@@1460323@
IV. TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên, cacbon tồn tại ở cả dạng đơn chất và hợp chất.
Dạng đơn chất:
- Kim cương và than chì là cacbon tự do gần như tinh khiết.
Dạng hợp chất:
- Có ở trong các khoáng vật như canxit (đá vôi, đá phấn... chứa CaCO3) magiezit (MgCO3), đolomit (CaCO3.MgCO3) và là thành phần chính của các loại than mỏ, dầu mỏ, khí thiên nhiên.
- Hợp chất của cacbon còn là thành phần của cơ sở tế bào động vật và thực vật.
V. ỨNG DỤNG - ĐIỀU CHẾ
1. Ứng dụng
- Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh, làm bột mài.
- Than chì được dùng làm điện cực, làm nồi để nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, làm bút chì đen.
- Than cốc dùng làm chất khử trong luyện kim, để luyện kim loại từ quặng.
- Than gỗ được dùng để chế tạo thuốc nổ đen, thuốc pháo,...
- Than hoạt tính có khả năng hấp phụ mạnh được dùng làm mặt lạ phòng độc và trong công nghiệp hóa chất.
- Than muội được dùng làm chất độn cao su, sản xuất mực in, xi đánh giầy,...
2. Điều chế
- Kim cương nhân tạo được điều chế bằng cách nung than chì ở khoảng 2000oC, áp suất 50 đến 100 nghìn atmotphe với xúc tác là sắt, crom hoặc niken.
- Than chì nhân tạo được điều chế bằng cách nung than cốc ở 2500 - 3000oC trong lò điện, không có mặt không khí.
- Than cốc được điều chế bằng cách nung than mỡ khoảng 1000oC trong lò cốc, không có không khí.
- Than mỏ được khai thác trực tiếp từ các vỉa than nằm dưới mặt đất.
- Than gỗ được tạo nên khi đốt gỗ trong điều kiện thiếu không khí.
- Than muội được tạo nên khi nhiệt phân metan có chất xúc tác:
CH4 \(\underrightarrow{t^o,xt}\) C + 2H2
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!