Bài 16: Điện phân
Nội dung lý thuyết
I. Hiện tượng điện phân
1. Khái niệm
- Điện phân là một quá trình oxi hóa – khử xảy ra tại các điện cực khi có dòng điện một chiều với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
- Chất tham gia vào quá trình điện phân có thể ở trạng thái nóng chảy (điện phân nóng chảy) hoặc dung dịch (điện phân dung dịch).
- Trong quá trình điện phân, dưới tác dụng của điện trường, các ion âm sẽ di chuyển về điện cực dương, các ion dương sẽ di chuyển về điện cực âm.
- Khi điện phân dung dịch, nước cũng có thể tham gia điện phân với vai trò chất khử (2H2O → O2 + 4H+ + 4e) hoặc chất oxi hóa (2H2O + 2e → H2 + 2OH-).
- Theo quy ước chung, đối với cả pin điện và bình điện phân, tại cathode xảy ra quá trình khử và tại anode xảy ra quá trình oxi hóa. Do vậy, trong điện phân cathode là cực âm, anode là cực dương.
Ví dụ: Quá trình điện phân NaCl nóng chảy được tiến hành như sau:
+ Bước 1: Nung NaCl trong bình đến nóng chảy, thu được chất lỏng có khả năng dẫn điện.
+ Bước 2: Nhúng hai điện cực than chì vào bình đựng NaCl nóng chảy rồi nối chúng với hai cực của nguồn điện một chiều (khoảng 7 V). Các ion di chuyển về các điện cực trái dấu, ở điện cực dương có khí Cl2 thoát ra và ở điện cực âm, Na được tạo thành.
2. Nguyên tắc (thứ tự) điện phân
- Khi bình điện phân chứa nhiều chất oxi hóa và chất khử, các quá trình xảy ra tại anode và cathode tuân theo thứ tự sau:
+ Tại anode: chất khử mạnh hơn bị oxi hóa trước.
Ví dụ: I- > Br- > Cl- (các anion như CO32-, NO3-, PO43-, SO42-, F- và ClO4- coi như không bị điện phân).
+ Tại cathode: chất oxi hóa yếu mạnh hơn bị khử trước.
Ví dụ: Au3+ > Ag+ > Hg2+ > Cu2+ > H+ > H2O
a) Điện phân dung dịch CuSO4 với các điện cực trơ (graphite)
CuSO4 → Cu2+ + SO42-
| Tại anode: SO42-, H2O | Tại cathode: Cu2+, H2O |
| 2H2O → O2 + 4H+ + 4e | Cu2+ + 2e → Cu |
- Phương trình hóa học của quá trình điện phân:
CuSO4 + H2O → Cu + ½ O2 + H2SO4
b) Điện phân dung dịch NaCl với các điện cực trơ
NaCl → Na+ + Cl-
Tại anode: Cl-, H2O 2Cl- → Cl2 + 2e | Tại cathode: Na+, H2O H2O + 2e → H2 + 2OH- |
⇒ Phương trình điện phân: NaCl + H2O \(\underrightarrow{\text{đpdd}}\) NaOH + Cl2 + H2
- Trong quá trình điện phân, sản phẩm tạo thành ở hai điện cực khuếch tán vào nhau sẽ xảy ra phản ứng:
NaOH + Cl2 → NaCl + NaClO + H2O
II. Ứng dụng của phương pháp điện phân
1. Sản xuất kim loại
- Trong công nghiệp, một số kim loại trung bình và yếu được sản xuất bằng phương pháp điện phân dung dịch; các kim loại mạnh như Na, K, Mg, Ca, Al,... được sản xuất bằng phương pháp điện phân nóng chảy hợp chất ion của chúng.
+ Hơn 50% sản lượng kẽm trên thế giới được sản xuất bằng phương pháp điện phân:
ZnSO4 + H2O → Zn+ 1/2O2 + H2SO4
+ Trong công nghiệp, nhôm được sản xuất từ quặng bauxite bằng cách điện phân nóng chảy Al2O3 trong quặng cùng cryolite (tạo thành hỗn hợp nóng chảy ở nhiệt độ gần 1000oC giúp tiết kiệm năng lượng, đồng thời tọa ra chất lỏng có tính dẫn điện tốt, nổi lên trên Al lỏng để ngăn cách Al lỏng với không khí).
2Al2O3 \(\xrightarrow[\text{cryolite}]{\text{đpnc}}\) 4Al + 3O2
Thùng điện phân có cathode là tấm than chì ở dưới đáy thùng, anode là những tấm than chì có thể di chuyển theo phương thẳng đứng.
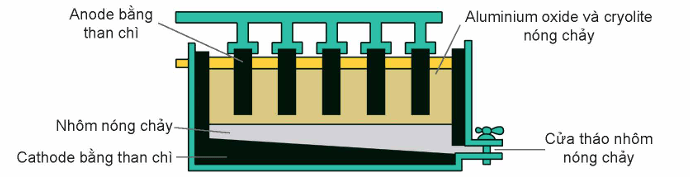
Khí O2 tạo thành ở nhiệt độ cao, đốt cháy dần điện cực anode than chì thành CO và CO2. Do vậy, trong quá trình điện phân phải hạ thấp dần các điện cực anode vào thùng điện phân.
2. Tinh chế kim loại
- Từ nguồn kim loại thô (kim loại phế liệu hoặc sau quá trình nhiệt luyện, thủy luyện), các kim loại như Zn, Ni, Co, Cu, Ag, Au,... được tinh chế bằng phương pháp điện phân.
- Quá trình tinh chế được thực hiện bằng cách điện phân dung dịch chất tan của kim loại đó với anode làm bằng kim loại thô tương ứng.
Ví dụ: Trong công nghiệp, đồng phế liệu hoặc đồng thô được tinh chế bằng phương pháp điện phân. Bình điện phân tinh chế đồng chức dung dịch muối CuSO4 trong dung dịch H2SO4, anode bằng đồng thô và cathode là đồng tinh khiết.
Tại anode: Cu bị oxi hóa thành ion Cu2+ đi vào dung dịch Cu → Cu2+ + 2e | Tại cathode: Cu2+ bị thử thành Cu bám trên cathode: Cu2+ + 2e → Cu |
Quá trình điện phân này được coi như là sự chuyển dời kim loại Cu từ anode về cathode. Kết thúc quá trình điện phân thu được đồng tinh khiết ở cathode.
3. Mạ điện
- Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
- Trong kĩ thuật mạ điện, các kim loại mạ thường là chromium, nickel, đồng, vàng, bạc, platinum,...
- Bình mạ điện chứa dung dịch muối của kim loại mạ, vật cần mạ và thanh kim loại mạ.
Ví dụ: Quá trình điện phân để mạ đồng lên một chiếc chìa khóa được mô tả trong hình sau.
.png)
Trong quá trình điện phân, thanh kim loại đóng vai trò là anode, chiếc chìa khóa đóng vai trò là cathode và dung dịch điện phân là dung dịch CuSO4. Các quá trình xảy ra ở các điện cực tương tự như quá trình điện phân tinh chế đồng với anode tan. Độ dày của lớp mạ tỉ lệ thuận với cường độ dòng điện chạy qua dung dịch điện phân và thời gian mạ.