Bài 15: Thế điện cực và nguồn điện hóa học
Nội dung lý thuyết
I. Cặp oxi hóa – khử
Dạng oxi hóa (Mn+) và dạng khử (M) của cùng một kim loại tạo nên cặp oxi hóa – khử Mn+/M, giữa chúng có mối quan hệ:
Mn+ + ne ⇌ M
Ví dụ: Al3+/Al; Zn2+/Zn; Cu2+/Cu;...
| Al3+ + 3e ⇌ Al | Zn2+ + 2e ⇌ Zn | Cu2+ + 2e ⇌ Cu |
II. Thế điện cực chuẩn
1. Điện cực
- Ứng với mỗi cặp oxi hóa – khử có thể thiết lập một điện cực, tại đó tồn tại cân bằng giữa dạng oxi hóa và dạng khử.
Ví dụ: Đối với cặp Zn2+/Zn, thiết lập được điện cực kẽm bằng cách cho thanh Zn tiếp xúc trực tiếp với dung dịch muối chứa ion Zn2+.
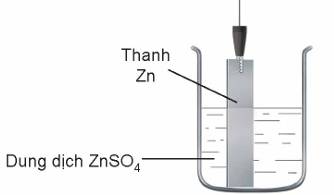
Tại ranh giới giữa kim loại và dung dịch chất điện li của điện cực tồn tại cân bằng:
Zn2+ + 2e ⇌ Zn
- Điện cực kim loại có nồng độ ion kim loại bằng 1M và nhiệt độ thường được chọn là 25oC (298K) được gọi là điện cực ở điều kiện chuẩn.
2. Thế điện cực chuẩn
- Mỗi điện cực ở điều kiện chuẩn có một đại lượng đặc trưng về điện thế, gọi là thế điện cực chuẩn.
- Thế điện cực chuẩn gắn liền với cặp oxi hóa – khử tương ứng nên thường được kí hiệu là \(E^o_{\text{oxi hóa/khử}}\) và thường có đơn vị là volt (vôn).
- Quy ước thế điện cực chuẩn của hydrogen bằng 0:
| 2H+ + 2e ⇌ H2 | \(E^o_{2H^+/H_2}=0\) |
Xác định được thế điện cực chuẩn của một điện cực khác trên cơ sở đo sự chênh lệch điện thế giữa điện cực đó với điện cực hydogen chuẩn.
Ví dụ:
| Zn2+ + 2e ⇌ Zn | \(E^o_{Zn^{2+}/Zn}=-0,762V\) |
| Cu2+ + 2e ⇌ Cu | \(E^o_{Cu^{2+}/Cu}=+0,340V\) |
Bảng dưới đây thể hiện giá trị thế điện cực chuẩn của một số cặp oxi hóa - khử.
| Nguyên tố | Bán phản ứng | Thế điện cực chuẩn Eo (V) |
| Li | Li + 1e ⇌ Li | -3,040 |
| K | K+ + 1e ⇌ K | -2,924 |
| Ba | Ba2+ + 2e ⇌ Ba | -2,92 |
| Ca | Ca2+ + 2e ⇌ Ca | -2,84 |
| Na | Na+ + 1e ⇌ Na | -2,713 |
| Mg | Mg2+ + 2e ⇌ Mg | -2,356 |
| Al | Al3+ + 3e ⇌ Al | -1,676 |
| Zn | Zn2+ + 2e ⇌ Zn | -0,762 |
| Cr | Cr3+ + 3e ⇌ Cr | -0,74 |
| Fe | Fe2+ + 2e ⇌ Fe | -0,44 |
| H2 | 2H2O + 2e ⇌ H2 + 2OH- | -0,414 |
| Cd | Cd2+ + 2e ⇌ Cd | -0,403 |
| Ni | Ni2+ + 2e ⇌ Ni | -0,257 |
| Sn | Sn2+ + 2e ⇌ Sn | -0,137 |
| Pb | Pb2+ + 2e ⇌ Pb | -0,126 |
| H2 | 2H+ + 2e ⇌ H2 | 0,000 |
| Cu | Cu2+ + 2e ⇌ Cu | +0,340 |
| Fe | Fe3+ + 1e ⇌ Fe2+ | +0,771 |
| Ag | Ag+ + 1e ⇌ Ag | +0,799 |
| Hg | Hg2+ + 2e ⇌ Hg | +0,853 |
| Br | Br2(aq) + 2e ⇌ 2Br- | +1,087 |
| O | O2 + 4H+ + 4e ⇌ 2H2O | +1,229 |
| Cl | Cl2 (aq) + 2e = 2Cl- | +1,358 |
| Au | Au3+ + 3e ⇌ Au | +1,52 |
3. Ý nghĩa của thế điện cực chuẩn
a) So sánh tính khử, tính oxi hóa giữa các cặp oxi hóa – khử
- Giữa hai cặp oxi hóa – khử, cặp có giá trị thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn, còn dạng oxi hóa có tính oxi hóa yếu hơn và ngược lại.
Ví dụ: \(E^o_{Cu^{2+}/Cu}=+0,340V\) < \(E^o_{Ag^+/Ag}=+0,799V\) nên tính khử của Cu mạnh hơn Ag, tính oxi hóa của ion Cu2+ yếu hơn Ag+ ở điều kiện chuẩn.
- Trên cơ sở so sánh giá trị thế điện cực chuẩn, các cặp oxi hóa – khử Mn+/M được sắp xếp thành dãy theo chiều tăng dần thế điện cực chuẩn, thường gọi là dãy điện hóa của kim loại:

b) Dự đoán chiều phản ứng giữa hai cặp oxi hóa – khử
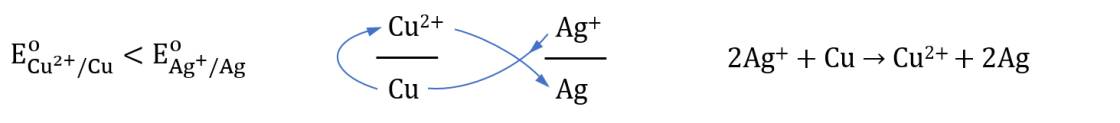
- Quy tắc alpha: chất khử của cặp oxi hóa – khử có thế điện cực nhỏ hơn (đứng trước trong dãy điện hóa) tác dụng với chất oxi hóa của cặp oxi hóa – khử có thế điện cực lớn hơn (đứng sau trong dãy điện hóa), tạo ra dạng oxi hóa và khử tương ứng.
Ví dụ: Sau khi sắp xếp, hai cặp oxi hóa – khử Cu2+/Cu và Ag+/Ag theo chiều tăng dần của thế điện cực chuẩn thì vận dụng quy tắc alpha như sau:
III. Pin điện hóa
1. Phản ứng oxi hóa – khử và dòng điện
- Phản ứng oxi hóa – khử luôn kèm theo sự chuyển electron từ chất khử sang chất oxi hóa. Nếu các quá trình oxi hóa, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hóa qua dây dẫn thì năng lượng của phản ứng hóa học sẽ chuyển thành năng lượng điện.
- Pin điện hóa là thiết bị chuyển hóa năng lượng của phản ứng oxi hóa – khử thành dòng điện.
2. Pin galvani
- Pin galvani là pin điện hóa có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hóa – khử và thường nối với nhau qua cầu muối.
+ Khi pin hoạt động, ở cực âm (anode) xảy ra quá trình oxi hóa ,cung cấp electron; ở cực dương (cathode) xảy ra quá trình khử, là nơi nhận electron. Các electron theo dây dẫn di chuyển từ anode sang cathode.
+ Vai trò của cầu muối: cho phép các ion di chuyển qua, do đó đóng kín mạch điện và duy trì tính trung hòa của mỗi dung dịch.
+ Sức điện động của pin đo ở điều kiện chuẩn gọi là sức điện động chuẩn. Sức điện động chuẩn có thể xác định dựa vào thế điện cực chuẩn của các cặp oxi hóa – khử tương ứng:
Eopin = Eocathode – Eoanode
Ví dụ: Ở 25oC, nhúng một thanh Zn vào cốc đựng dung dịch ZnSO4 1M, nhúng một thanh Cu vào cốc đựng dung dịch CuSO4 1M. Nối thanh Zn và thành Cu bằng dây dẫn, lắp một vôn kế để đo hiệu điện thế. Đóng kín mạch bằng một cầu muối.
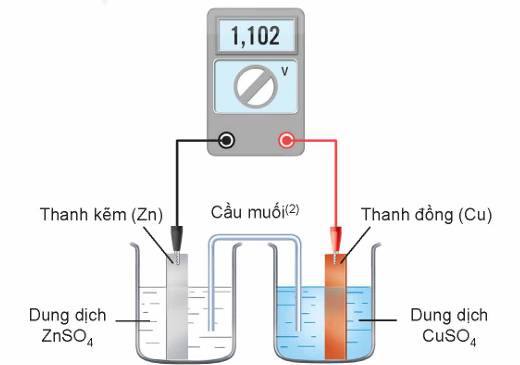
+ Tại anode: Zn ⇌ Zn2+ + 2e \(E^o_{Zn^{2+}/Zn}=-0,762V=E^o_{anode}\)
+ Tại cathode: Cu2+ + 2e ⇌ Cu \(E^o_{Cu^{2+}/Cu}=+0,340V=E^o_{cathode}\)
+ Phản ứng hóa học xảy ra trong pin: Zn + Cu2+ = Zn2+ + Cu
+ Sức điện động chuẩn của pin Zn – Cu:
Eopin = Eocathode – Eoanode = 0,340 – (-0,762) = 1,102 (V).
IV. Một số loại pin khác
Hiện nay, có nhiều loại pin đang được sử dụng phổ biến như acquy, pin nhiên liệu, pin Mặt Trời,...
| Pin | Khái quát | Ưu điểm | Nhược điểm |
| Acquy chì | - Thuộc loại pin thứ cấp (pin sạc), các chất phản ứng được tái tạo trong quá trình sạc bằng dòng điện một chiều. - Được sử dụng phổ biến trong các phương tiện giao thông, thiết bị điện, phát điện. | - Dễ sản xuất, giá thành thấp. - Hoạt động ổn định. - Dễ thu hồi sulfuric acid và chì để tái chế. | - Nặng, tuổi thọ thấp (khoảng 1 năm). - Gây ô nhiễm môi trường và ngộ độc chì ở các làng nghề tái chế acquy cũ. |
| Pin nhiên liệu | - Pin điện hóa chuyển đổi hóa năng thành điện năng thông qua phản ứng oxi hóa – khử giữa nhiên liệu (methane, methanol, ethanol, hydrogen,...) và chất oxi hóa (thường là oxygen) | - Điều chỉnh được cường độ dòng điện nhờ thay đổi tốc độ dòng nhiên liệu. - Hiệu suất chuyển đổi năng lượng cao, lượng chất phát thải ít và dễ kiểm soát. | Giá thành cao. |
| Pin Mặt Trời | Gồm nhiều tấm vật liệu bán dẫn được ghép nối với nhau, có khả năng chuyển đổi quang năng thành điện năng. | - Nguồn năng lượng sạch, không phát thải khí gây ô nhiễm môi trường. - Tận dụng được năng lượng vô tận của Mặt Trời. | - Sản xuất phức tạp, giá thành cao. - Phụ thuộc vào khí hậu, thời tiết. - Pin Mặt Trời hết hạn có nguy cơ gây ô nhiễm môi trường. |