Bài 12: Liên kết hydrogen và tương tác Van der Waals
Nội dung lý thuyết
I. Liên kết hydrogen
1. Khái niệm
Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác có độ âm điện lớn còn cặp electron hoá trị riêng.
- Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Ký hiệu của liên kết hydrogen: dấu ba chấm (…), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
- Liên kết hydrogen có bản chất tĩnh điện, đó là tương tác hút tĩnh điện giữa H và Y:
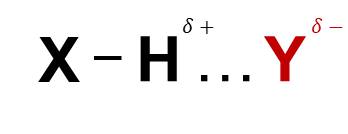
Mô hình liên kết hydrogen
@3006026@
VD: Giữa các phân tử H2O có một liên kết yếu được tạo thành do lực hút tĩnh điện giữa nguyên tử H mang một phần điện tích dương của phân tử H2O này với nguyên tử O mang một phần điện tích âm của phân tử H2O khác. Liên kết này là liên kết hydrogen, thường được biểu diễn bằng dấu ba chấm (…).
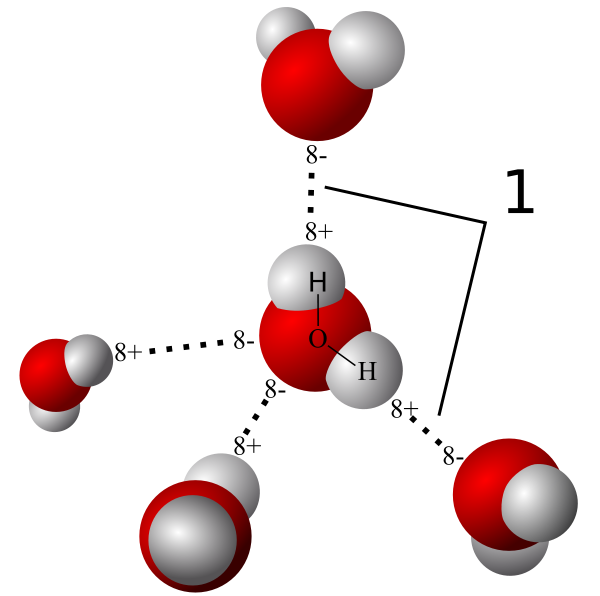
Mô hình liên kết hydrogen trong phân tử nước
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a. Đặc điểm của tập hợp
- Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả thể hơi, thành một cụm phân tử. Kích thước các cụm phân tử này thay đổi tuỳ theo điều kiện nhiệt độ, áp suất.
b. Nhiệt độ nóng chảy và nhiệt độ sôi
- Tại áp suất 1 atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn.
- Nguyên nhân: Do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
VD: H2O và H2S có cấu trúc phân tử tương tự nhau. Nhưng H2O do tạo được liên kết hydrogen nên có nhiệt độ sôi và nhiệt độ nóng chảy lớn hơn nhiều so với H2S không tạo được liên kết hydrogen.
II. Tương tác van der Waals
1. Khái niệm
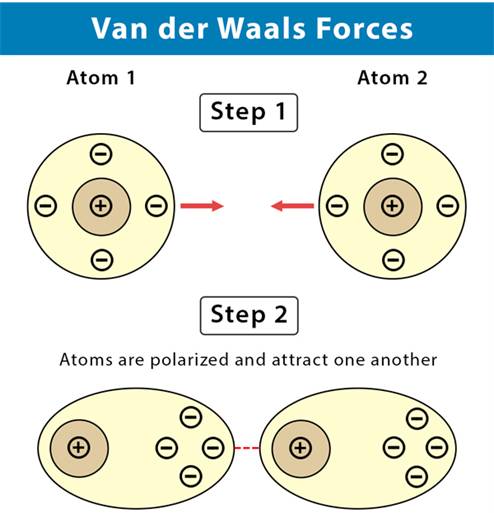
Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng.
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất

Tương tác van der Waals của các nguyên tử Ne
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất nhưng mức độ ảnh hưởng yếu hơn so với liên kết hydrogen
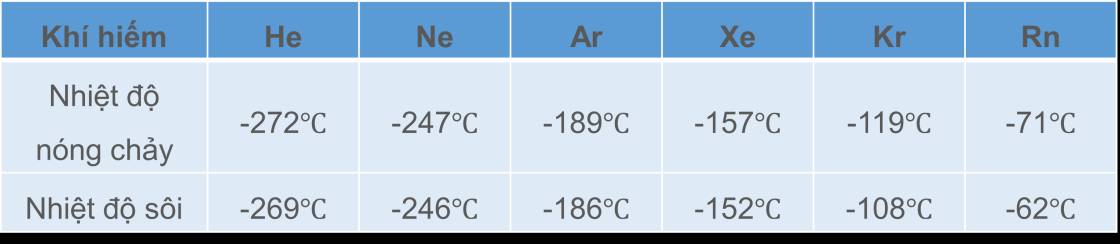
Bảng: Nhiệt độ sôi và nhiệt độ nóng chảy của các khí hiếm
@3006102@
Các em đã học
1. Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là F, O, N.
2. Tương tác van der Waals là một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
3. Liên kết hydrogen và tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Trong đó, liên kết hydrogen có ảnh hưởng mạnh hơn.
