Quan sát hình 24.1, mô tả và giải thích hiện tượng xảy ra.
Có hiện tượng trên là do trong giấm ăn có acetic acid. Vậy acetic acid có cấu tạo như thế nào và có những tính chất gì?

Chuẩn bị: Dung dịch CH3COOH 1 M, phoi bào magnesium; ống nghiệm.
Tiến hành: Cho 1 – 2 mL dung dịch acetic acid 1M vào ống nghiệm, sau đó thêm vào vài mẩu magnesium.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Tham khảo
-Hiện tượng: phoi bào magnesium tan, xuất hiện bọt khí.
-Giải thích: Acetic acid phản ứng với magnesium, làm magnesium tan và tạo khí hydrogen.
2CH3COOH + Mg → 2(CH3COO)2Mg + H2↑
Acetic acid và methyl formate có cấu tạo hóa học như sau:
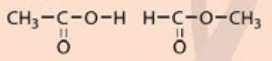
Giải thích vì sao mặc dù cùng có công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate.
Tính chất của các chất phụ thuộc vào thành phần phân tử (loại nguyên tố, số lượng nguyên tử) và cấu tạo hoá học (trật tự liên kết của các nguyên tử với nhau). Cụ thể ở đây :
- Acetic acid (CH3COOH): có 2 nguyên tử C liên kết với nhau (C - C).
- Methyl fomate (HCOOCH3): có 2 nguyên tử C liên kết với nguyên tử O (C - O - C)
Vì thế nên mặc dù có cùng công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate.
Acetic acid và methyl formate có cấu tạo hoá học như sau:
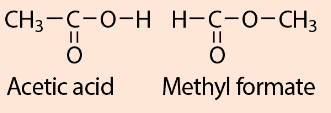
Giải thích vì sao mặc dù có cùng công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate.
Tham khảo:
Tính chất của các chất phụ thuộc vào thành phần phân tử (loại nguyên tố, số lượng nguyên tử) và cấu tạo hoá học (trật tự liên kết của các nguyên tử với nhau). Do đó dù có cùng công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate do cấu tạo hoá học khác nhau.
Acetic acid có trong giấm ăn và là chất được sử dụng nhiều trong công nghiệp; oxygen chiếm khoảng 21% thể tích không khí, có vai trò quan trọng đối với sự sống; hydrogen peroxide có nhiều ứng dụng trong công nghiệp và là chất sát khuẩn mạnh. Quan sát hình 4.8, cho biết chất nào là đơn chất, chất nào là hợp chất?

-Acetic acid được tạo thành từ 3 nguyên tố C, H và O
=>Nó là hợp chất
-Oxygen được tạo thành từ 1 nguyên tố O
=> Nó là đơn chất
-Hydrogen peroxide được tạo thành từ 2 nguyên tố O và H
=> Nó là hợp chất
a) Acetic acid (CH3COOH) là hợp chất vì: Có cấu tạo từ 3 nguyên tố hóa học là: Carbon(C), Hydrogen(H) và Oxygen(O).
b) Oxygen là đơn chất vì: Có cấu tạo từ 1 nguyên tố hóa học duy nhất là Oxygen.
c) Hydrogen peroxide (H2O2) là hợp chất vì: Có cấu tạo từ 2 nguyên tố hóa học là: Hydrogen(H) và Oxygen(O).
a) Acetic acid=> hợp chất( GỒM: O,H,C)
b) Oxygen=>đơn chất(O)
c) Hydrogen peroxide =>hợp chất(O,H)
Nêu hiện tượng và viết pthh
1. Cho mẩu kim loại sodium (hoặc Potassium) vào rượu Ethanol
2.Thả mẩu kim loại Magesium Mg vào gốc đựng giấm (dd loãng của Acetic acid)
3.Cho Acetic acid vào ống nghiệm đựng bột CaO
1) Mẩu kim loại tan dần, có khí không màu thoát ra
2Na + 2C2H5OH --> 2C2H5ONa + H2
2K + 2C2H5OH --> 2C2H5OK + H2
2) Mẩu kim loại tan dần, có khí không màu thoát ra
Mg + 2CH3COOH --> (CH3COO)2Mg + H2
3) Bột CaO tan dần
CaO + 2CH3COOH --> (CH3COO)2Ca + H2O
Phương pháp điều chế acetic acid bằng cách lên men giấm cần thực hiện trong những điều kiện nào? Giải thích. Nêu những ứng dụng trong thực tiễn của phương pháp trên.
Phương pháp điều chế acetic acid bằng cách lên men giấm cần thực hiện trong những điều kiện nào
- Vật dụng đựng giấm phải được tiệt trùng trước: Vì giấm có tính acid nên rất dễ trở thành dung môi hòa tan các chất độc hại trong vật liệu đựng. Các loại sành có chất liệu chính là đất nung nên có khả năng chứa các kim loại nặng, nếu dùng để đựng giấm dễ có nguy cơ thôi nhiễm, không tốt cho sức khỏe.
- Trước khi đậy nắp hũ để ủ giấm, sử dụng một tấm vải mỏng phủ lên miệng hũ, vì men giấm cần không khí để có thể phát triển nên bít một tấm vải lên như vậy vừa đảm bảo tránh được côn trùng và bụi bẩn, vừa có thể để không khí lọt vào hũ.
- Nhiệt độ thích hợp giúp mem giấm phát triển tốt là 20oC - 30oC
Nói chung tuân thủ về kín khí, nhiệt độ, dụng cụ tiệt trùng và nguyên liệu phải sạch
Ứng dụng thực tiễn của phương pháp lên men giấm, có thể sử dụng làm thực phẩm và còn được sử dụng nhiều trong làm đẹp, đời sống va y tế như: khắc phục bong gân, máu bầm; Kiểm soát lượng đường trong máu; Hỗ trợ hấp thu các chất dinh dưỡng khác; giúp ngủ ngon; chống lão hóa da; giảm nám bằng giấm; lưu giữ mùi vị và màu sắc món ăn; tác dụng kháng khuẩn;...
Hãy viết công thức cấu tạo của acetic acid. Cho biết một số tính chất hoá học và ứng dụng của acetic acid mà em biết.
CTCT của acetic acid: \(CH_3-COOH\)
Một số tính chất hóa học:
- Hợp chất hữu cơ có tính axit mạnh, làm quỳ chuyển sang màu đỏ.
- Tác dụng được với kim loại trước H, oxit bazo, bazo, muối trung hòa, muối axit, rượu.
Ứng dụng của acetic acid:
- dung môi hòa tan các chất hóa học, sản xuất thuốc nhuộm, bảo quản thực phẩm...
Mô tả những gì quan sát được. Trong hai ống nghiệm, ở ống nào xảy ra hiện tượng vật lí, ống nào xảy ra hiện tượng hóa học? Giải thích.
Hiện tượng:
Ống nghiệm 1: Chất rắn tan hết tạo thành dung dịch màu tím.
Ống nghiệm 2: Tàn đóm đỏ bùng cháy. Hòa vào nước chất rắn còn lại một phần không tan hết.
Giải thích:
Ống 1: Thuộc hiện tượng vật lí vì không có sự biến đổi về chất.
Ống 2: Thuộc hiện tượng hóa học vì có chất mới sinh ra (khí oxi làm cho tàn đóm bùng cháy, chất không tan hết là manganđioxit).
Nêu hiện tượng và pthh
a)Cho khí Ethylene?Acetylene đi qua dung dịch Bromine Br2
b)Cho Acetic acid vào ống nhghieemj có chứa đấ vôi vooi Caco3
a) dd Br2 nhạt màu dần
C2H4 + Br2 --> C2H4Br2
C2H2 + 2Br2 --> C2H2Br4
b) Chất rắn tan dần, sủi bọt khí
2CH3COOH + CaCO3 --> (CH3COO)2Ca + CO2 + H2O
Chuẩn bị: dung dịch acetic acid 10%, dung dịch Na2CO3 10%, bột Mg; ống nghiệm, giấy quỳ.
Tiến hành:
1. Phản ứng với chất chỉ thị:
Nhỏ một giọt dung dịch acetic acid 10% lên mẩu giấy quỳ.
Quan sát và mô tả sự thay đổi màu sắc của giấy quỳ.
2. Phản ứng với kim loại:
- Cho 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (1).
- Thêm tiếp một ít bột Mg vào ống nghiệm (1).
Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (1).
3. Phản ứng với muối:
- Cho 1 – 2 mL dung dịch Na2CO3 10% vào ống nghiệm (2).
- Thêm tiếp 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (2).
Thực hiện yêu cầu sau:
a) Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (2).
b) Viết phương trình hoá học của các phản ứng xảy ra trong các thí nghiệm trên và giải thích hiện tượng.
Tham khảo:
1. Quỳ tím chuyển sang màu đỏ vì acetic acid có tính acid.
2. Kim loại tan dần tạo thành dung dịch màu không màu và có khí không màu thoát ra.
- Mg + 2CH3COOH → (CH3COO)2Mg + H2
3. Tạo dung dịch không màu và có khí thoát ra.
- 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O