Viết cấu hình electron của các nguyên tố có số hiệu nguyên tử từ 1 đến 20.

Những câu hỏi liên quan
1. Viết cấu hình electron nguyên tử của các nguyên tố (có số hiệu nguyên tử từ 1 đến 20).
\(Z=1\Rightarrow1s^1\)
\(Z=2\Rightarrow1s^2\)
\(Z=3\Rightarrow1s^22s^1\)
\(Z=4\Rightarrow2s^22s^2\)
\(Z=5\Rightarrow1s^22s^22p^1\)
\(Z=6\Rightarrow1s^22s^22p^2\)
\(Z=7\Rightarrow1s^22s^22p^3\)
\(Z=8\Rightarrow1s^22s^22p^4\)
\(Z=8\Rightarrow1s^22s^22p^4\)
\(Z=9\Rightarrow1s^22s^22p^5\)
\(Z=10\Rightarrow1s^22s^22p^6\)
\(Z=11\Rightarrow1s^22s^22p^63s^1\)
Đúng 1
Bình luận (1)
Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố là 13.
Viết cấu hình electron nguyên tử của nguyên tố đó.
(Cho biết: các nguyên tố có số hiệu nguyên từ từ 2 đến 82 trong bảng tuần hoàn thì)
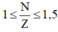
Z = 4 nên có cấu hình electron : 1s22s2.
Đúng 0
Bình luận (0)
Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố là 58
a, Xác định nguyên tử khối
b, Viết cấu hình electron nguyên tử của một nguyên tố đó
( Cho biết : Các nguyên tố có số hiệu nguyên tử từ 2 đến 82 trong bảng tuần hoàn thì 1 ≤ N/Z ≤ 1,5 )
Viết cấu hình electron nguyên tử các nguyên tố có số electron từ 1 đến 10
Xác định số hiệu và viết cấu hình electron nguyên tử của nguyên tố X từ các cơ sở sau:
Nguyên tử của nguyên tố X có tổng số electron ở các phân lớp s là 7, tổng số electron ở các phân lớp d là 7
Cấu hình: 1s22s22p63s23p63d74s1
=> Z= 26 (Sắt - Fe)
Đúng 0
Bình luận (0)
Phần 2. Bài tập tự luậnDạng 1. Viết cấu hình electron nguyên tử, xác định vị trí của nguyên tố trong BTHCâu 1. Viết cấu hình electron nguyên tử, xác định vị trí của chúng trong bảng tuần hoàn và dự đoán tính chất của các nguyên tố có số hiệu nguyên tử sau: a. Mg (Z 12) b. Al (Z 13) c. S (Z 16) d. Ar (Z 18).Câu 2. Cho các nguyên tố M (Z 11), X (Z 17), Y (Z 9) và R (Z 19).a. Viết cấu hình electron và xác định vị trí của các nguy...
Đọc tiếp
Phần 2. Bài tập tự luận
Dạng 1. Viết cấu hình electron nguyên tử, xác định vị trí của nguyên tố trong BTH
Câu 1. Viết cấu hình electron nguyên tử, xác định vị trí của chúng trong bảng tuần hoàn và dự đoán tính chất của các nguyên tố có số hiệu nguyên tử sau:
a. Mg (Z = 12) b. Al (Z = 13) c. S (Z = 16) d. Ar (Z = 18).
Câu 2. Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19).
a. Viết cấu hình electron và xác định vị trí của các nguyên tố trên trong bảng tuần hoàn.
b. Sắp xếp các nguyên tố trên theo chiều tăng dần độ âm điện và giải thích.
Dạng 3: Tìm tên kim loại dựa vào phương trình hóa học
Câu 3. Xác định hai kim loại cần tìm trong các trường hợp sau:
a. Cho 6 gam hỗn hợp hai kim loại thuộc nhóm IA và hai chu kì kế tiếp tác dụng vừa đủ với dung dịch HCl thấy thoát ra 2,24 lít khí H2 (ở đktc).
b. Cho 6,4 gam hỗn hợp 2 kim loại nhóm IIA, thuộc 2 chu kì liên tiếp tác dụng hết với dung dịch HCl dư thu được 4,48 lít khí H2 (đktc).
Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố là 13.
a) Xác định nguyên tử khối.
b) viết cấu hình electron nguyên tử nguyên tố đó.
Cho biết : Các nguyên tố có số hiệu nguyên tử từ 2 đến 82 trong bảng tuần hoàn thì 1<=\(\frac{N}{Z}\)<=1,5
HD: Cách 1:
a) Tổng số hạt là 13 nên số e = số proton = [13/3] (lấy phần nguyên) = 4. Như vậy số hạt notron = 13 - 2.4 = 5 hạt.
Suy ra số khối A = N + Z = 5 + 4 = 9 (Be).
b) 1s22s2.
Cách 2:
Gọi Z, N tương ứng là số hạt proton và notron của nguyên tố X. Ta có: 2Z + N = 13. Suy ra N = 13 - 2Z thay vào biểu thức 1 <= N/Z <= 1,5 thu được:
3,7 <= Z <= 4,3 mà Z nguyên nên Z = 4 (số hạt proton = số hạt electron), số hạt notron N = 13 - 2.4 = 5 hạt.
Đúng 1
Bình luận (3)
cho em hỏi làm sao sát định dc nguyên tử nguyên tố đố là bền không phóng xạ vậy
Đúng 0
Bình luận (1)
Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố Z là 24( Cho biết các nguyên tố có số hiệu nguyên tử từ 2- 82 trong bảng tuần hoàn thì : 1≤N/Z≤1,5
a. Tính số hạt proton, notron và electron trong nguyên tử Z
b. Viết cấu hình electron nguyên tử của Z
Ta có: \(1\le\dfrac{N}{Z}\le1,5\)
\(\Rightarrow Z\le N\le1,5Z\)
\(\Rightarrow3Z\le2Z+N\le3,5Z\)
Vậy ta có : \(3Z\le24\le3,5Z\)
=> \(6,86\le Z\le8\)
=>\(\left[{}\begin{matrix}Z=7\left(N\right)\\Z=8\left(O\right)\end{matrix}\right.\Rightarrow\left[{}\begin{matrix}N=10\\N=8\end{matrix}\right.\)
Mà theo đề bài : \(1\le\dfrac{N}{Z}\le1,5\)
=> Chỉ có O thỏa mãn
=> Z là O , số P= số E =8 , N=8
b) Cấu hình E: 1s22s22p4
Đúng 2
Bình luận (0)
Câu 2. Hai nguyên tố A và B ở hai phân nhóm chính liên tiếp trong bảng tuần hoàn các nguyên tố hốa học. Tống số hiệu nguyên tử của A và B là 31. Xác định số hiệu nguyên tử, viết cấu hình electron của các nguyên tử của A và B. Viết cấu hình electron của các ion tạo thành
Giả sử \(Z_A< Z_B\)
Theo bài ra, ta có: \(Z_A+Z_B=31\)
\(\Rightarrow Z_A+\left(Z_A+1\right)=31\) \(\Rightarrow\left\{{}\begin{matrix}Z_A=15\\Z_B=16\end{matrix}\right.\)
Cấu hình electron:
A: [Ne]3s23p3
B: [Ne]3s23p4
A3-: [Ne]3s23p6
B2-: [Ne]3s23p6
Đúng 2
Bình luận (0)
























