1. Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
2. Trình bày các bước lập công thức Lewis của phân tử ammonia.
Cho các phân tử sau: KCl, H 2 O , N 2 và N a 2 O .
Biết số hiệu nguyên tử của các nguyên tố lần lượt là: H = 1, N = 7, O = 8, Na = 11, Cl = 17, K = 19.
Viết công thức electron và công thức cấu tạo của các phân tử chứa liên kết cộng hoá trị.
Viết CT electron và công thức cấu tạo của phân tử chứa liên kết cộng hoá trị: N 2 và H 2 O (1,0 điểm)

Hãy viết cấu hình electron của các nguyên tử :
hiđro (H), Z = 1 ; liti (Li), Z = 3 ; natri (Na), Z = 11.
Cho nhận xét về số electron thuộc lớp ngoài cùng của các nguyên tử trên.
H: 1 s 1 Li: 1 s 2 2 s 1 ; Na: 1 s 2 2 s 2 2 p 6 3 s 1
Nhận xét: Lớp ngoài cùng của các nguyên tử đó đều có 1 electron trên phân lớp s.
Viết cấu hình electron nguyên tử và xác định số electron độc thân của các nguyên tố có Z = 7, , Z = 15, Z = 19, Z = 21, Z = 24, Z = 28, Z = 29 ?
Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố Z là 24( Cho biết các nguyên tố có số hiệu nguyên tử từ 2- 82 trong bảng tuần hoàn thì : 1≤N/Z≤1,5
a. Tính số hạt proton, notron và electron trong nguyên tử Z
b. Viết cấu hình electron nguyên tử của Z
Ta có: \(1\le\dfrac{N}{Z}\le1,5\)
\(\Rightarrow Z\le N\le1,5Z\)
\(\Rightarrow3Z\le2Z+N\le3,5Z\)
Vậy ta có : \(3Z\le24\le3,5Z\)
=> \(6,86\le Z\le8\)
=>\(\left[{}\begin{matrix}Z=7\left(N\right)\\Z=8\left(O\right)\end{matrix}\right.\Rightarrow\left[{}\begin{matrix}N=10\\N=8\end{matrix}\right.\)
Mà theo đề bài : \(1\le\dfrac{N}{Z}\le1,5\)
=> Chỉ có O thỏa mãn
=> Z là O , số P= số E =8 , N=8
b) Cấu hình E: 1s22s22p4
Mô tả sự hình thành phân tử N2 từ hai nguyên tử N. Phân tử N2 có bao nhiêu cặp electron dùng chung? Viết công thức Lewis của N2.
- Cấu hình electron của N (Z = 7): 1s22s22p3
- Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho 2 nguyên tử N.
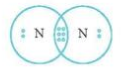
⟹ Số cặp electron dùng chung là 3.
⟹ Công thức Lewis của N2:
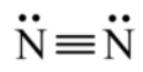
Cho nguyên tử N (Z=7). Hãy a) Viết cấu hình electron của nguyên tử N. Xác định vị trí của N trong bảng tuần hoàn. Giải thích? b) Nguyên tố N có tính kim loại, phi kim hay khí hiếm? Vì sao? c) Phân bố các electron vào các AO. Xác định số electron độc thân của N.
Hãy viết cấu hình electron của các nguyên tử :
oxi (O), Z = 8 ; flo (F), Z = 9 ; nitơ (N), Z = 7.
Hãy nhận xét về số electron thuộc lớp ngoài cùng của các nguyên tử trên. Các nguyên tố tương ứng thuộc loại nguyên tố gì (s, p hay d) ? Kim loại hay phi kim ?
O : 1 s 2 2 s 2 2 p 6
F : 1 s 2 2 s 2 2 p 5
N : 1 s 2 2 s 2 2 p 3
Các nguyên tử trên có nhiều electron ở lớp ngoài cùng (6, 7, 5).
Các nguyên tố tương ứng là những phi kim và cả ba đều là nguyên tố p.
Hãy viết cấu hình electron của các nguyên tử có Z = 3 đến Z = 10 và nhận xét về số electron thuộc lớp ngoài cùng của nguyên tử các nguyên tố trong dãy đó.
Từ Z = 3 đến Z = 10 ta có các nguyên tử :
Li: 1 s 2 2 s 1 ; Be: 1 s 2 2 s 2 ; B: 1 s 2 2 s 2 2 p 1 ; C: 1 s 2 2 s 2 2 p 2
N: 1 s 2 2 s 2 2 p 3 ; O: 1 s 2 2 s 2 2 p 4 ; F: 1 s 2 2 s 2 2 p 5 ; Ne: 1 s 2 2 s 2 2 p 6
Nhận xét : Số electron thuộc lớp ngoài cùng của các nguyên tử đó tăng dần từ 1 (Li) đến 8 (Ne).
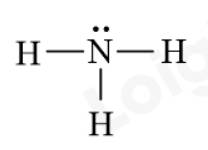
Hãy biểu diễn sự hình thành các cặp electron chung cho phân tử NH3. Từ đó, viết công thức Lewis của phân tử này.
Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1)
N (Z = 7): 1s22s22p3
H (Z = 1): 1s1
Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3
H có 1e ở lớp electron ngoài cùng, N có 5e ở lớp electron ngoài cùng.
⟹ Mỗi nguyên tử góp chung 1e để đạt cấu hình khí hiếm bền vững.
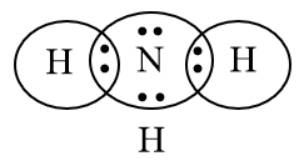
Bước 3: Công thức Lewis của NH3