Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-.

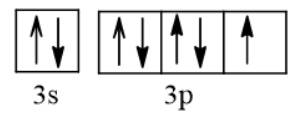
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng. a. Viết cấu hình electron của Na+ và Cl-. b. Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của Na+ và Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.
Tìm hiểu mối quan hệ giữa số electron ở lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự của nhóm
Chuẩn bị: 4 mô hình sắp xếp electron ở vỏ nguyên tử của Li, Na, F, Cl theo mẫu mô tả trong Hình 4.4.
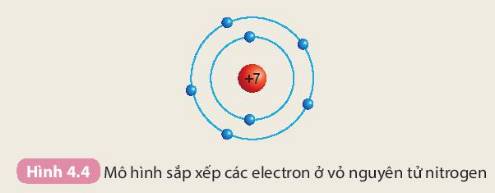
Quan sát các mô hình đã chuẩn bị, thảo luận và trả lời câu hỏi:
1. Hãy cho biết nguyên tử các nguyên tố nào có cùng số electron ở lớp ngoài cùng
2. Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố đó
1:
Nguyên tử Li, Na có cũng số electron ở lớp ngoài cùng
Nguyên tử F, Cl có cũng số electron ở lớp ngoài cùng
2: Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố
Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+

Ion Na+ ít hơn nguyên tử Na 1 eletron.
Ion Na+ ít hơn nguyên tử Na một lớp electron.
Hay nói cách khác nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương, kí hiệu là Na+.
Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
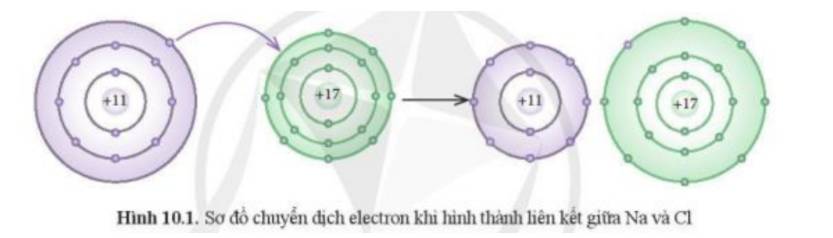
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1
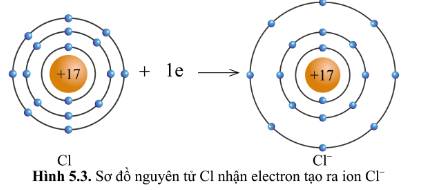
Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào.

- Xét ion Na+:
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion Cl-
+ Có 18 hình cầu màu xanh ở các đường tròn => Có 18 electron ở lớp vỏ
+ Có 3 đường tròn xung quanh hạt nhân => Có 3 lớp electron
=> Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ar
Hãy viết phương trình biểu diễn sự hình thành các ion và nhận xét về số electron lớp ngoài cùng, của các ion: Na+, Mg2+, Al3+, Cl-, S2-
\(Na\rightarrow Na^++e\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
\(Cl+e\rightarrow Cl^-\)
\(S+2e\rightarrow S^{2-}\)
Cấu hình:
\(Na^+:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Mg^{2+}:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Al^{3+}:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Cl^-:1s^22s^22p^63s^23p^6\) giống cấu hình của \(Ar\)
\(S^{2-}:1s^22s^22p^63s^23p^6\) giống cấu hình của \(Ar\)
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
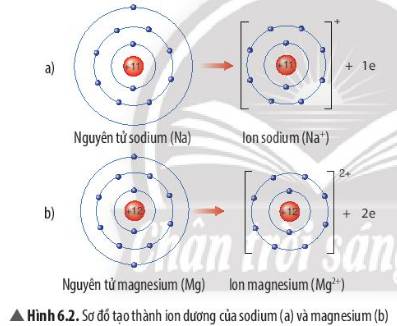
- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
Quan sát hình 3.5 và bảng tuần hoàn, hãy cho biết số electron lớp ngoài cùng của nguyên tử Li (lithium) và Cl (chlorine). Hai nguyên tố đó nằm ở nhóm nào trong bảng tuần hoàn?
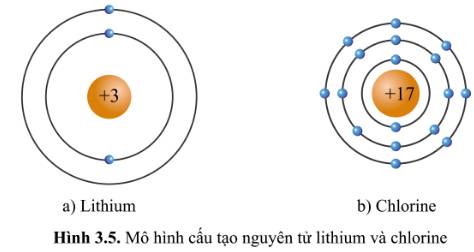
- Xét mô hình cấu tạo của nguyên tử lithium: có 1 hình tròn xanh ở vòng tròn ngoài cùng => Có 1 electron ở lớp vỏ ngoài cùng => Thuộc nhóm IA
- Xét mô hình cấu tạo của nguyên tử chlorine: có 7 hình tròn xanh ở vòng tròn ngoài cùng => Có 7 electron ở lớp vỏ ngoài cùng => Thuộc nhóm VIIA