Cho một lượng bột sắt tan hoàn toàn trong dung dịch H2SO4 đặc, nóng có nồng độ 78,4% thấy giải phóng khí SO2 và thu được dung dịch X, trong X nồng độ phần trăm của Fe2(SO4)3 sinh ra và của H2SO4 dư bằng nhau.Viết PTHH và tính nồng độ phần trăm của Fe2(SO4)3 và H2SO4 trong dung dịch X

Những câu hỏi liên quan
Cho bột sắt tác dụng hoàn toàn với lượng dư dung dịch H2SO4 đặc, nóng nồng độ 78,4%, thu được dung dịch A, trong đó nồng độ phần trăm của Fe2(SO4)3 và H2SO4 dư bằng nhau, giải phóng khí SO2.a) Tính nồng độ phần trăm của muối sắt và H2SO4 dư trong dung dịch A.b) Tính thể tích dung dịch NaOH 2M cần để tác dụng hết với 50 gam dung dịch A.
Đọc tiếp
Cho bột sắt tác dụng hoàn toàn với lượng dư dung dịch H2SO4 đặc, nóng nồng độ 78,4%, thu được dung dịch A, trong đó nồng độ phần trăm của Fe2(SO4)3 và H2SO4 dư bằng nhau, giải phóng khí SO2.
a) Tính nồng độ phần trăm của muối sắt và H2SO4 dư trong dung dịch A.
b) Tính thể tích dung dịch NaOH 2M cần để tác dụng hết với 50 gam dung dịch A.
Cho bột iron tác dụng hoàn toàn với lượng dư dd H2SO4 đặc, nồng độ 78,4% thu được dd A trong đó nồng độ % của Fe2(SO4)3 và H2SO4 dư = nhau, giải phóng SO2. Tính nồng độ % của Fe2(SO4)3 và H2SO4 dư
Giả sử có 1 mol Fe tác dụng
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
1---->3----------->0,5------->1,5
Giả sử khối lượng dd H2SO4 78,4% là m (gam)
=> \(m_{H_2SO_4\left(bđ\right)}=\dfrac{m.78,4}{100}=0,784m\left(g\right)\)
=> \(m_{H_2SO_4\left(dư\right)}=0,784m-3.98=0,784m-294\left(g\right)\)
mdd sau pư = 1.56 + m - 1,5.64 = m - 40 (g)
Do C% của Fe2(SO4)3 và H2SO4 dư là bằng nhau
=> \(m_{Fe_2\left(SO_4\right)_3}=m_{H_2SO_4\left(dư\right)}\)
=> 400.0,5 = 0,784m - 294
=> m = \(\dfrac{30875}{49}\left(g\right)\)
mdd sau pư = \(\dfrac{28915}{49}\left(g\right)\)
=> \(C\%_{Fe_2\left(SO_4\right)_3}=C\%_{H_2SO_4\left(dư\right)}=\dfrac{200}{\dfrac{28915}{49}}.100\%=33,89\%\)
Đúng 4
Bình luận (0)
1.Hòa tan 1 oxit có hóa trị không đổi bằng một lượng vừa đủ 9,8% thu được dung dịch muối có nồng độ 11,54%.Tìm oxit
2. Cho bột Fe tác dụng với H2SO4 đặc nóng 78,40% thu được dung dịch A, trong đó nồng độ phần trăm của Fe2(SO4)3 và H2SO4 dư bằng nhau và giải phóng khí SO2 . Tính nồng độ phần trăm Fe2(SO4)3 và H2SO4 dư
Hòa tan hết 9 gam hỗn hợp (dạng bột) gồm Al và Mg trong 100 gam dung dịch H2SO4 đặc, nóng (dư), thu được dung dịch A, có khối lượng giảm 8,7 gam và hỗn hợp khí B gồm H2S, SO2. Cho toàn bộ lượng khí B vào dung dịch Pb(NO3)2 dư, thu được 11,95 gam kết tủa.a) Tính nồng độ phần trăm của H2SO4 ban đầu, biết lượng axit dư chiếm 25% so với lượng ban đầu.b) Tính nồng độ phần trăm của các chất trong dung dịch A.
Đọc tiếp
Hòa tan hết 9 gam hỗn hợp (dạng bột) gồm Al và Mg trong 100 gam dung dịch H2SO4 đặc, nóng (dư), thu được dung dịch A, có khối lượng giảm 8,7 gam và hỗn hợp khí B gồm H2S, SO2. Cho toàn bộ lượng khí B vào dung dịch Pb(NO3)2 dư, thu được 11,95 gam kết tủa.
a) Tính nồng độ phần trăm của H2SO4 ban đầu, biết lượng axit dư chiếm 25% so với lượng ban đầu.
b) Tính nồng độ phần trăm của các chất trong dung dịch A.
cho bột sắt tan hoàn toàn trong 300g dd H2SO4 đặc nóng ,nồng độ 78,4% thu đc 16,8l khí SO2(đktc) và dd A . tính nồng độ % cuả chất tan trong dd A
Ta có: \(n_{SO_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
\(m_{H_2SO_4}=300.78,4\%=235,2\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{235,2}{98}=2,4\left(mol\right)\)
PT: \(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
____0,5____1,5________0,25______0,75 (mol)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=2,4-1,5=0,9\left(mol\right)\)
Ta có: m dd sau pư = mFe + m dd H2SO4 - mSO2
= 0,5.56 + 300 - 0,75.64 = 280 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,9.98}{280}.100\%=31,5\%\\C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,25.400}{280}.100\%\approx35,7\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Oxi hóa toàn 12,395 lít SO2 (đkc) bằng không khí (dư) ở nhiệt độ cao, có chất xúc tác. Hòa tan toàn bộ sản phẩm vào 210 gam dung dịch H2SO4 10% thu được dung dịch X. Các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm khối lượng của dung dịch X là
Ta có: \(n_{SO_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
BTNT S, có: nH2SO4 = nSO3 = nSO2 = 0,5 (mol)
Mà: mH2SO4 (ban đầu) = 210.10% = 21 (g)
⇒ mH2SO4 (trong X) = 21 + 0,5.98 = 70 (g)
Có: m dd X = 210 + mSO3 = 210 + 0,5.80 = 250 (g)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{70}{250}.100\%=28\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH 2. Thể tích của dung dịch X là A. 2,00 lít B. 1,150 lít C. 1,114 lít D. 2,28 lít
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH = 2. Thể tích của dung dịch X là
A. 2,00 lít
B. 1,150 lít
C. 1,114 lít
D. 2,28 lít
Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa cuối cùng của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S + 4 .
Khi đó, có các quá trình nhường và nhận electron như sau:
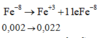
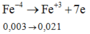
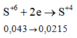

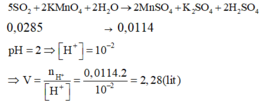
Đáp án D
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.a) Tính m và C.b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
Đọc tiếp
Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.
a) Tính m và C.
b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)
Đúng 0
Bình luận (0)
cho bột sắt tác dụng hoàn toàn với lượng dư dung dịch H2SO4 đặc nóng độ 78,4% thu được dung dịch A trong đó nồng độ % của Fe2(SO4)3 và của H2SO4 dư bằng nhau và giải phóng khí SO2 .Tính nồng độ % của Fe2(SO4)3 và H2SO4 dư.
Câu 7. Cho tan hoàn toàn 3,6 gam hỗn hợp gồm Mg và Fe trong dung dịch H2SO4 đặc, nóng, dư, thu được dung dịch D (MgSO4, Fe2(SO4)3, H2SO4 dư), 2,24 lít khí SO2 (đkc). Cho dung dịch D tác dụng với dung dịch NaOH lấy dư, lọc và nung kết tủa (Mg(OH)2, Fe(OH)3) đến khối lượng thu được m gam chất rắn (MgO, Fe2O3). a) Viết các phương trình phản ứng. b)Tính giá trị của m . ( 5,2 gam)khỏi viết pthh phản ứng ạ
Đọc tiếp
Câu 7. Cho tan hoàn toàn 3,6 gam hỗn hợp gồm Mg và Fe trong dung dịch H2SO4 đặc, nóng, dư, thu được dung dịch D (MgSO4, Fe2(SO4)3, H2SO4 dư), 2,24 lít khí SO2 (đkc). Cho dung dịch D tác dụng với dung dịch NaOH lấy dư, lọc và nung kết tủa (Mg(OH)2, Fe(OH)3) đến khối lượng thu được m gam chất rắn (MgO, Fe2O3).
a) Viết các phương trình phản ứng.
b)Tính giá trị của m . ( 5,2 gam)
khỏi viết pthh phản ứng ạ


















