Trình bày sơ đồ cách tiến hành phân tích cation và anion tronh dung dịch ? Mn giúp e với ạ

Những câu hỏi liên quan
Trình bày sơ đồ cách tiến hành phân tích hỗn hợp cation và anion trong dung dịch? Mọi người giúp e với ạ
Có 3 dung dịch: HCL, H2SO4, BACL2 đựng trong 3 lọ. Bằng phương pháp hóa học, em hãy trình bày cách tiến hành hoặc lập sơ đồ nhận biết các chất trên. Viết các pthh xảy ra( nếu có)
Cho quỳ tím vào từng mẫu thử
+ Quỳ hóa đỏ: H2SO4, HCl
+ Quỳ không đổi màu: BaCl2
Cho dung dịch BaCl2 đã nhận ở trên vào 2 mẫu thử làm quỳ hóa đỏ
+ Kết tủa: H2SO4
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)
+ Không hiện tượng : HCl
Đúng 3
Bình luận (0)
Cách tiến hành thí nghiệm lý:Với các dụng cụ nguồn điện 1 chiều, ampe kế, vôn kế, biến trở, khóa K, dây nối, ...(ampe kế và vôn kế có thể xê dịch đến vị trí khác trong mạch điện), hãy trình bày cách tiến hành thí nghiệm, ( vẽ sơ đồ mạch điện) để kiểm nghiệm các tính chất của đoạn mạch gồm hai điện trở nối tiếp, song song, hỗn hợp ( Th1 mạch là mạch nt, TH2: mạch chính là mạch song song)
Đọc tiếp
Cách tiến hành thí nghiệm lý:
Với các dụng cụ nguồn điện 1 chiều, ampe kế, vôn kế, biến trở, khóa K, dây nối, ...(ampe kế và vôn kế có thể xê dịch đến vị trí khác trong mạch điện), hãy trình bày cách tiến hành thí nghiệm, ( vẽ sơ đồ mạch điện) để kiểm nghiệm các tính chất của đoạn mạch gồm hai điện trở nối tiếp, song song, hỗn hợp ( Th1 mạch là mạch nt, TH2: mạch chính là mạch song song)
Câu hỏi Hóa lý:
a) Trình bày những luận điểm cơ bản của thuyết VB?
b) Dựa trên quan điểm của thuyết MO-Huckel hãy xây dựng sơ đồ khung phân tử cho các chất sau:
+) Gốc C3H5 (mạch thẳng); cation C3H5; anion C3H5;
+) Phân tử C4H6 (mạch thẳng, mạch vòng);
+) Gốc C4H5 (mạch vòng).
Xem thêm câu trả lời
Có 3 lọ mất nhãn , mỗi lọ đựng trong các dung dịch là:H2SO4 loãng, HNO3, NANO3 . Trình bày cách tiến hành thí nghiệm để nhận biết dung dịch chất đựng trong mỗi lọ. mong mn giup minh
Cho quỳ tím vào từng mẫu thử
+ Quỳ hóa đỏ: H2SO4, HNO3
+ Quỳ không đổi màu: NaNO3
Cho dung dịch BaCl2 vào 2 mẫu làm quỳ hóa đỏ
+ Kết tủa: H2SO4
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
+ Không hiện tượng: HNO3
Đúng 1
Bình luận (1)
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây? A. (2) B. (4) C. (1) D. (3)
Đọc tiếp
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a < 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây?




A. (2)
B. (4)
C. (1)
D. (3)
Chọn D.
Theo đề ta có: a < 2b nên KCl
điện phân hết còn CuSO4 dư.
Catot: Cu2+ + 2e ® Cu
Anot: 2Cl– ® Cl2 + 2e
2H2O ® 4H++O2+ 4e
+ Quá trình 1: Không đổi
+ Quá trình 2: [H+] tăng Þ PH giảm
Đúng 0
Bình luận (0)
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây? A. (2). B. (4). C. (1). D. (3).
Đọc tiếp
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a < 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây?

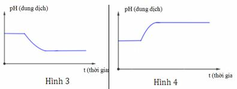
A. (2).
B. (4).
C. (1).
D. (3).
1) Có 4 cation K+, Ag+, Ba2+, Cu2+ và 4 anion Cl-, NO3-, SO42-, CO32-. Có thể hình thành bốn dung dịch nào từ các ion trên? nếu mỗi dung dịch chỉ chứa 1 cation và 1 anion (không trùng lặp).
Có dung dịch chứa đồng thời các cation Fe2+, Al3+. Trình bày cách tách và nhận biết mỗi ion từ dung dịch của hỗn hợp.
∗ Cách tách 2 ion từ hỗn hợp:
- Cho NaOH đến dư vào hỗn hợp ta thu được hai phần : kết tủa là Fe(OH)3, dung dịch là NaAlO2, NaOH dư
Fe2+ + 2NaOH → Fe(OH)2 + 2Na+
Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3
Al3+ + 3NaOH → 2Na+ + Al(OH)3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Tách kết tủa: hòa tan kết tủa trong HCl thu được muối
Fe(OH)3 + HCl → FeCl3 + 2H2O
Sau đó cho Fe vào dd để thu được muối Fe2+
Fe + 2HCl → FeCl2 + H2↑
Fe + 2FeCl3 → 3FeCl2
- Phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3
NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
Hòa tan kết tủa trong HCl thu muối Al3+
Al(OH)3 + 3HCl → AlCl3 + 3H2O
∗ Nhận biết mỗi ion từ hỗn hợp
Cho NaOH vào hỗn hợp hai cation, nếu thấy xuất hiện kết tủa trắng xanh là Fe(OH)2 đem để ngoài không khí thấy có kết tủa nâu đỏ đó là Fe(OH)3 ⇒ chứng tỏ có ion Fe2+
Nếu thấy dung dịch có kết tủa keo trắng sau đó tan ra trong NaOH dư thì có ion Al3+.
PTHH: tương tự như phần tách chất.
Đúng 0
Bình luận (0)