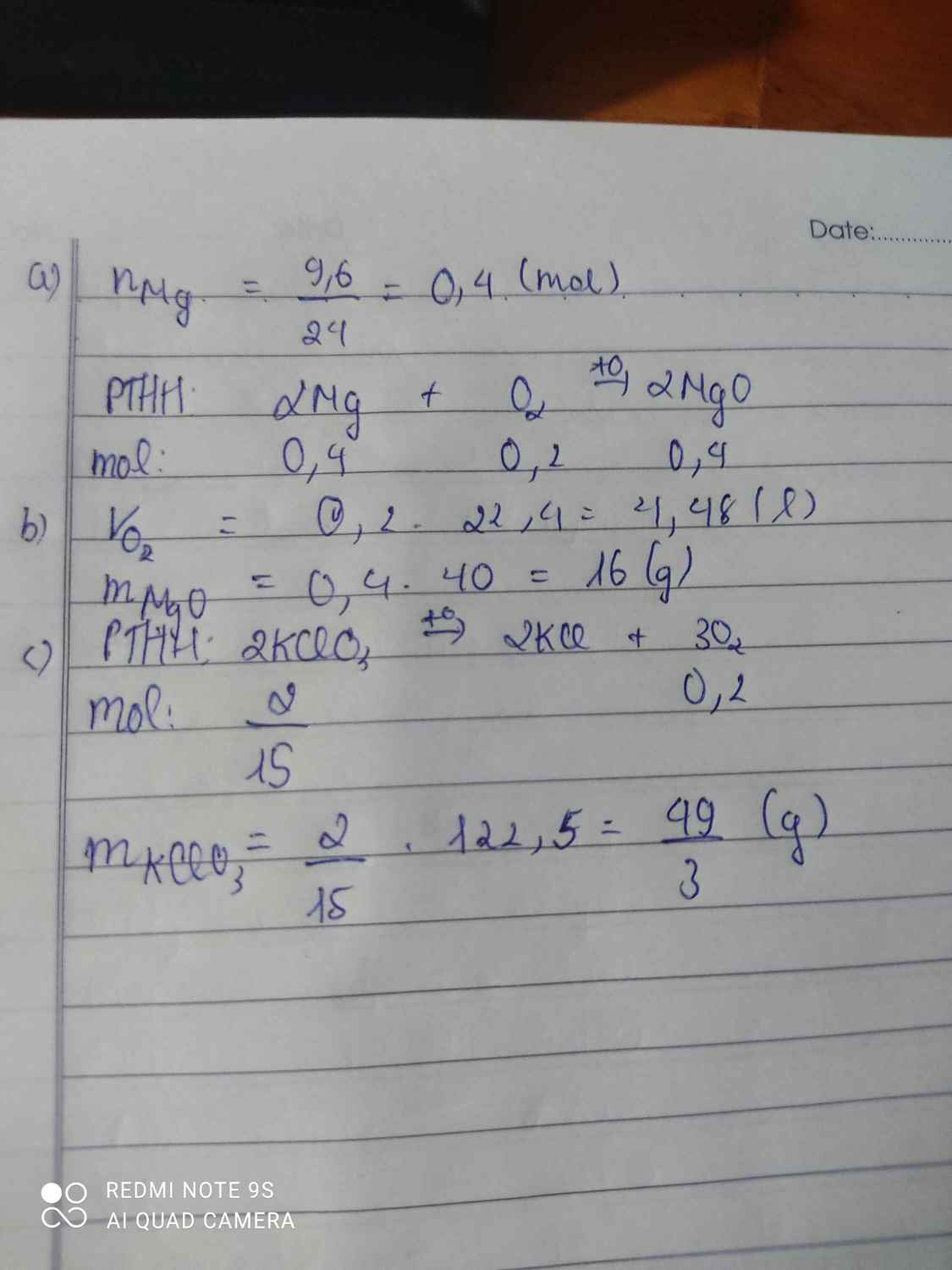Đốt cháy hết hidrocacbon A trong V lít oxi vừa thu đc 9,6 lít cacbonic(đkt) và 3,6g nước.Tính V

Những câu hỏi liên quan
Đốt cháy V(lit) khí C2H6 cần dùng 56 lít không khí ở đktc thu đc khí cacbonic và nước. Biết trong không khí oxi chiếm 20% thể tích. Tính V ở đktc
Đốt cháy a gam Nhôm trong bình có chứa 6 lít Oxi(ĐKT). Sau khi Nhôm cháy xong thu được 10,2 g Nhôm Oxit.
a) Đã đốt cháy hết bao nhiêu gam Nhôm?
b) Khí Oxi có lấy dư bao nhiêu %?
\(n_{O_2}=\dfrac{6}{24}=0,25\left(mol\right)\\ 4Al+3O_2\underrightarrow{to}2Al_2O_3\\ n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\\ Vì:\dfrac{0,25}{3}>\dfrac{0,1}{2}\\ \Rightarrow O_2dư\\ n_{O_2\left(p.ứ\right)}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\\ n_{Al\left(p.ứ\right)}=\dfrac{4}{2}.0,1=0,2\left(mol\right)\\ a.m_{Al\left(p.ứ\right)}=0,2.27=5,4\left(g\right)\\ b.\%m_{O_2\left(dư\right)}=\%V_{O_2\left(dư\right)}=\%n_{O_2\left(dư\right)}=\dfrac{0,25-0,15}{0,15}.100\approx66,667\%\)
Đúng 0
Bình luận (0)
Đốt cháy 18,9g nhôm trong bình chứa V lít khí (ở đkt), oxi chiếm 20% thể tích, thu được chất rắn A.Cho A phản ứng hết với dung dịch Axit Sunfuric loãng thấy sinh ra 3,36 lít khí.a) Tính giá trị Vb)Tính khối lượng H2SO4 (H2O chiếm 24,5% về khối lượng)c) Tính khối lượng muối thu được khi cho toàn bộ lượng nhôm nói trên hóa hợp với lưu huỳnh bằng cách nung nóng hỗn hợp ѵà lưu huỳnh trong điều kiện không có không khí.
Đọc tiếp
Đốt cháy 18,9g nhôm trong bình chứa V lít khí (ở đkt), oxi chiếm 20% thể tích, thu được chất rắn A.Cho A phản ứng hết với dung dịch Axit Sunfuric loãng thấy sinh ra 3,36 lít khí.
a) Tính giá trị V
b)Tính khối lượng H2SO4 (H2O chiếm 24,5% về khối lượng)
c) Tính khối lượng muối thu được khi cho toàn bộ lượng nhôm nói trên hóa hợp với lưu huỳnh bằng cách nung nóng hỗn hợp ѵà lưu huỳnh trong điều kiện không có không khí.
\(n_{Al}=\dfrac{18,9}{27}=0,7\left(mol\right)\\
pthh:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,7 0,525 0,35
\(V_{O_2}=\left(0,525.24\right)=12,6l\)
\(2Al+3S\underrightarrow{t^o}Al_2S_3\)
0,7 0,35
\(m_{Al_2S_3}=0,35.150=52,5g\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn m gam hh CH4,C2H4,C3H4,C4H4 cần 41,44 lít không khí(oxi chiếm 20% thể tích không khí)(đktc) thu được V lít CO2(đktc) và 4,68 g nước.Tính giá trị của m và V.
\(n_{O_2}=\dfrac{41,44}{22,4}.20\%=0,37(mol)\\ n_{H_2O}=\dfrac{4,68}{18}=0,26(mol)\)
Bảo toàn nguyên tố (O): \(n_{CO_2}=n_{O_2}=0,37(mol)\)
\(\Rightarrow V_{CO_2}=0,37.22,4=8,288(l)\)
BTKL: \(m_{hh}=m_{CO_2}+m_{H_2O}-m_{O_2}=0,37.44+4,68-0,37.32=9,12(g)\)
Đúng 1
Bình luận (0)
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy 9,6 gam Mg trong bình đựng V lít khí oxi vừa đủ (đktc) thu được x gam sản phẩm (là hợp chất của Mg và oxi).
a/ Viết phương trình hóa học của phản ứng xảy ra.
b/ Tìm x, V.
c/ Để có được lượng oxi trên, cần dùng bao nhiêu gam KClO3, biết khi nung KClO3 ta thu được khí oxi và chất rắn KCl.
\(a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ b,n_{Mg}=\dfrac{9,6}{24}=0,4\left(mol\right)\\ n_{MgO}=n_{Mg}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ b,x=m_{MgO}=40.0,4=16\left(g\right)\\ V=V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ c,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\uparrow\\ n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
Đúng 4
Bình luận (0)
a, 2Mg + O2 \(\rightarrow\) 2MgO (bạn thêm to trên cái mũi tên nhé)
b, nMg = \(\dfrac{9,6}{24}\) = 0,4 (mol)
PTPƯ: 2Mg + O2 \(\rightarrow\) 2MgO
2g/mol 1g/mol 2g/mol
\(\Rightarrow\) 0,4 0,2 0,4
VO2 = 0,2 . 22,4 = 4,48l
mMgO = 0,4 . (24 + 16) = 16(g)
Đúng 0
Bình luận (2)
Đốt cháy hoàn toàn 9,2g hỗn hợp gồm CH3OH , C2H5OH , C3H7OH , C4H9OH cần dùng vừa đủ 13,44 lít khí oxi(đktc) . Sau pư thu đc V lít CO2 (đktc) và m gam H2O. Giá trị V và m lần lượt là?
Đặt \(\left\{{}\begin{matrix}n_{CO_2}=a\left(mol\right)\\n_{H_2O}=b\left(mol\right)\end{matrix}\right.\)
Ta thấy các chất đều có công thức CnH2n+2O \(\Rightarrow n_{O\left(hỗnhợp\right)}=n_{H_2O}-n_{CO_2}\)
\(\Rightarrow n_{O\left(ancol\right)}=b-a\)
Ta có: \(m_{hh}=m_C+m_H+m_O=9,2\left(g\right)\) \(\Rightarrow a+2b+16\left(b-a\right)=9,2\) (1)
Mặt khác: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn oxi: \(\left(b-a\right)+2\cdot0,6=2a+b\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{CO_2}=0,4\left(mol\right)\\b=n_{H_2O}=\dfrac{38}{45}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,4\cdot22,4=8,96\left(l\right)\\m_{H_2O}=15,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Đốt cháy cacbon vừa đủ trong V lít oxi, sau phản ứng thu được 6.72 lít hỗn hợp khí A gồm 2 khí CO và CO2. Biết d A/ SO3 = 5/12. Tính V
Đốt cháy hoàn toàn 1,64 gam hỗn hợp các hidrocacbon trong vừa đủ V lít O2 (đktc) thu được m gam CO2 và 1,8 gam H2O. Xác định giá trị của m và V
Ta có: \(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\Rightarrow n_H=0,1.2=0,2\left(mol\right)\)
⇒ mC = 1,64 - mH = 1,24 (g) ⇒ nC = 0,12 (mol) = nCO2
⇒ mCO2 = 0,12.44 = 5,28 (g)
BTNT O, có: 2nO2 = 2nCO2 + nH2O ⇒ nO2 = 0,17 (mol)
⇒ VO2 = 0,17.22,4 = 3,808 (l)
Đúng 2
Bình luận (0)