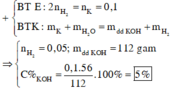Cho 3,9 gam k tác dụng với 101,8 gam nước tính nồng độ phần trăm của dung dịch thu được

Những câu hỏi liên quan
2) Cho 3,9 gam K tác dụng hoàn toàn với 96,2 gam nước. Tính thể tích khí thu được ở (đktc) và nồng độ phần trăm của dung dịch bazơ (KOH) tạo thành sau phản ứng?
Ta có : \(n_K=\dfrac{m}{M}=\dfrac{3,9}{39}=0,1\) (mol)
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{96,2}{18}=5,34\)(mol)
Phương trình hóa học :
2K + 2H2O ---> 2KOH + H2
2 : 2 : 2 : 1
Nhận thấy \(\dfrac{n_K}{n_{H_2O}}=\dfrac{0,1}{5,34}< \dfrac{2}{2}\)
=> Kali hết , nước dư
=> \(n_{H_2}=\dfrac{n_K}{2}=0,05\) (mol)
=> Thể tích khí H2 : V = n.22,4 = 0,05.22,4 = 1,12(l)
Lại có \(n_{KOH}=0,1\) (mol) => \(m_{KOH}=0,1.56=5,6\) (g)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)
Nồng độ phần trăm của Base thu được :
\(C\%=\dfrac{m_{KOH}}{m_{dd}-m_{H_2}}=\dfrac{5,6}{96,2+3,9-0,1}=0,056=5,6\%\)
Đúng 1
Bình luận (0)
Cho 3,9 gam Kali tác dụng với 101,8 gam nước. C% của dung dịch thu được là
A. 3,8%
B. 5,3%
C. 5,5%
D. 5,2%
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam Kali tác dụng với 108,2 gam H 2 O là
A. 5,00%.
B. 6,00%.
C. 4,99%.
D. 4,00%.
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là A. 5,00%. B. 6,00%. C. 4,99%. D. 4,00%.
Đọc tiếp
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 5,00%.
B. 6,00%.
C. 4,99%.
D. 4,00%.
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là ?
Khối lượng dung dịch = 108,2 + 3,9 - 0,1 = 112 gam
Khối lượng chất tan = 0,1 x 56 = 5,6 gam
Nồng độ % = 5,6/112 = 0,05 = 5/100 = 5%
Đúng 0
Bình luận (0)
cho 11,2 gam sắt tác dụng vừa đủ với 200 gam dung dịch HCL. a) tính nồng độ phần trăm của dung dịch HCL. b) tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng?
a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{HCl} =2 n_{Fe} = 0,2.2 = 0,4(mol)$
$C\%_{HCl} = \dfrac{0,4.36,5}{200}.100\% = 7,3\%$
b) $n_{H_2} = n_{FeCl_2} = n_{Fe} = 0,2(mol)
Sau phản ứng, $m_{dd} = 11,2 + 200 - 0,2.2 = 210,8(gam)$
$C\%_{FeCl_2} = \dfrac{0,2.127}{210,8}.100\% = 12,05\%$
Đúng 2
Bình luận (0)
VI.30
cho 3,9 g kali(K) tác dụng với 101,8 g nước. xảy ra phương trình:
2K+2H2O------>2KOH+H2
tính nồng độ phần trăm của dung dịch thu được
\(2K\left(0,1\right)+2H_2O\left(0,1\right)\rightarrow2KOH\left(0,1\right)+H_2\)
\(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2O\left(pứ\right)}=0,1.18=1,8\left(g\right)\)
\(\Rightarrow m_{H_2O\left(dư\right)}=101,8-1,8=100\left(g\right)\)
\(\Rightarrow m_{KOH}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow C\%\left(KOH\right)=\dfrac{5,6}{100+5,6}.100\%=5,3\%\)
Đúng 0
Bình luận (0)
Cho 23 gam Na tác dụng với 100 gam nước. Nồng độ phần trăm của dung dịch thu được là
A. 23,8%.
B. 30,8%.
C. 32,8%.
D. 29,8%.
Đáp án C
Ta có phản ứng:
2Na + 2H2 → 2NaOH + H2↑.
+ Ta có nNa = 1 mol ⇒ nH2 = 0,5 mol
⇒ mH2 = 0,5×2 = 1 gam.
⇒ mDung dịch sau phản ứng = 23 + 100 – 1 = 122 gam.
+ Ta có nNaOH = 1 mol ⇒ mNaOH = 40 gam.
⇒ C%NaOH = 40 122 × 100 ≈ 32,8%
Đúng 0
Bình luận (0)
Cho 23 gam Na tác dụng với 100 gam nước. Nồng độ phần trăm của dung dịch thu được là
A. 23,8%.
B. 30,8%.
C. 32,8%.
D. 29,8%.
Đáp án C
Ta có phản ứng: 2Na + 2H2 → 2NaOH + H2↑.
+ Ta có nNa = 1 mol ⇒ nH2 = 0,5 mol
⇒ mH2 = 0,5×2 = 1 gam.
⇒ mDung dịch sau phản ứng = 23 + 100 – 1 = 122 gam.
+ Ta có nNaOH = 1 mol ⇒ mNaOH = 40 gam.
⇒ C%NaOH = 40 122 × 100 ≈ 32,8%
Đúng 0
Bình luận (0)
Cho 9,2 gam Na tác dụng với 200 gam nước.
a. Tính thể tích khí thoát ra (ở đktc).
b. Tính nồng độ phần trăm của dung dịch thu được.
Ta có: \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(PTHH:2Na+2H_2O--->2NaOH+H_2\uparrow\)
a. Theo PT: \(n_{H_2}=\dfrac{1}{2}.n_{Na}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(lít\right)\)
b. Theo PT: \(n_{NaOH}=n_{Na}=0,4\left(mol\right)\)
\(\Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\)
Ta có: \(m_{dd_{NaOH}}=9,2+200-0,2.2=208,8\left(g\right)\)
\(\Rightarrow C_{\%_{NaOH}}=\dfrac{16}{208,8}.100\%=7,66\%\)
Đúng 1
Bình luận (0)