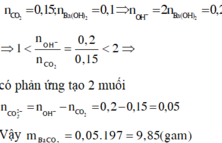Hấp thụ V(lít) so2 vào 100ml dung dịch ba(oh)2 1M thu được 17,36g kết tủa. Tính V?

Những câu hỏi liên quan
Hấp thụ V (lít) so2 vào 100ml dung dịch ba(oh)2 1M. Tính khối lượng kết tủa
\(Ba(OH)_2 + SO_2 \to BaSO_3 + H_2O\\ n_{BaSO_3} = n_{Ba(OH)_2} = 0,1(mol)\\ \Rightarrow m_{BaSO_3} = 0,1.217 = 21,7(gam)\)
Đúng 2
Bình luận (0)
Hấp thụ V lít SO2 (đktc) vào 300ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V?
A. 2,24
B. 1,12
C. 11,2
D. A & C
Đáp án D.
Trường hợp 1: Ba(OH)2 dư, SO2 hết , nBaSO3 = nSO2
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 ← 0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH)2 hết, SO2 dư nhưng không hòa tan hết kết tủa (kết tủa chỉ tan một phần)
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1 ← 0,1
Ba(OH)2 + 2SO2 → Ba(HSO3)2
( 0,3 – 0,1)→ 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
Đúng 0
Bình luận (0)
Tính thể tích khí so2 đã hấp thụ vào a) 100ml dung dịch Ca(OH)2 0,05M đẻ tạo được 0,3 gam kết tủa b) 200ml dung dịch hỗn hợp NaOH 2M và Ba(OH)2 1M, được 29,55 gam kết tủa c) 200ml dung dịch hỗn hợp NaOH 2M và Ba(OH)2 1M, được 39,4 gam kết tủa
Xem chi tiết
Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 100ml dung dịch Ba(OH)2 1M, thu được m gam kết tủa. Giá trị của m là A. 1,97. B. 3,94. C. 19,7. D. 9,85.
Đọc tiếp
Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 100ml dung dịch Ba(OH)2 1M, thu được m gam kết tủa. Giá trị của m là
A. 1,97.
B. 3,94.
C. 19,7.
D. 9,85.
Hấp thụ hết 5,6 lít SO2 9 ở (đktc) vào V lít dung dịch Ba(OH)2 1M thu được 29,55 gam kết tủa. Giá trị nhỏ nhất của V là bao nhiêu?
Please help me!
SO2 + Ba(OH)2 --> BaSO3 + H2O
nSO2 = \(\frac{5,6}{22,4}\)= 0,25 mol
nBaSO3 = \(\frac{29,55}{137+32+16.3}\)= 0,136 mol
=> Ba(OH)2 hết, SO2 dư
=> nBa(OH)2 = 0,136 mol
=> VBa(OH)2 = \(\frac{n}{CM}\)= \(\frac{0,136}{1}\)= 0,136l
Hấp thụ V lít SO2 (đktc) vào dung dịch Ca(OH)2 thu được 2,4 gam kết tủa. Thêm tiếp dung dịch Ca(OH)2 dư vào bình, thu thêm được 3,6 gam kết tủa. Giá trị của V là:
A. 1,120
B. 2,240
C. 4,480
D. 1,792
\(Ca(HSO_3)_2+ Ca(OH)_2 \to 2CaSO_3\ + 2H_2O\\ n_{Ca(HSO_3)_2} = \dfrac{1}{2}n_{CaSO_3} = \dfrac{1}{2}.\dfrac{3,6}{120} = 0,015(mol)\\ Ca(OH)_2 + SO_2 \to CaSO_3 + H_2O\\ Ca(OH)_2 + 2SO_2 \to Ca(HSO_3)_2\\ n_{SO_2} = 2n_{Ca(HSO_3)_2} + n_{CaSO_3} = 0,015.2 + \dfrac{2,4}{120}=0,05(mol)\\ V = 0,05.22,4 = 1,12(lít)\)
Đúng 1
Bình luận (0)
Hấp thụ V lít khí SO2 (đktc) vào 300ml dung dịch Ba(OH)2 1M tạo ra 21,7 gam kết tủa. Tìm Vmin và Vmax thỏa mãn bài toán
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 thì thu được 19,7 gam kết tủa. Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 và a mol NaOH thì thu được 39,4 gam kết tủa. Giá trị của V và a tương ứng là A. 5,60 và 0,2 B. 6,72 và 0,1 C. 8,96 và 0,3 D. 6,72 và 0,2
Đọc tiếp
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 thì thu được 19,7 gam kết tủa. Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 và a mol NaOH thì thu được 39,4 gam kết tủa. Giá trị của V và a tương ứng là
A. 5,60 và 0,2
B. 6,72 và 0,1
C. 8,96 và 0,3
D. 6,72 và 0,2
Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.
Đúng 0
Bình luận (0)
hấp thụ v lít CO2 vào 200ml dung dịch Ba(OH)2 0,3M. sau phản ứng, thu được 3,94 gam kết tủa. tính V
Ta có: \(\left\{{}\begin{matrix}n_{BaCO_3}=\dfrac{3,94}{197}=0,02\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,2\cdot0,3=0,06\left(mol\right)\end{matrix}\right.\)
+) Trường hợp 1: Chỉ tạo muối trung hòa
Bảo toàn nguyên tố: \(n_{CO_2}=n_{BaCO_3}=0,02\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,02\cdot22,4=0,448\left(l\right)\)
+) Trường hợp 2: Tạo 2 muối
PTHH: \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
0,02_____0,02______0,02 (mol)
\(2CO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HCO_3\right)_2\)
0,08______0,04_________0,04 (mol)
\(\Rightarrow n_{CO_2}=0,1\left(mol\right)\) \(\Rightarrow V_{CO_2}=0,1\cdot22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)