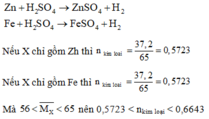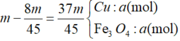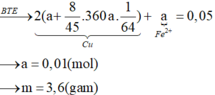Hoà tan 2,8g hỗn hợp Ca & CaCO3 bằng dung dịch HCl dư thu được dung dịch Y và 896 cm khối hỗn hợp X gồm 2 khí ở đktc . Cô cạn dung dịch Y thu được m gam muối khan.
a,Tính m và số gam mỗi chất trong hỗn hợp ban đầu.
b, Tính dX/H2
c, Cho tất cả khí X nói trên hấp thụ hết trong 100 ml dung dịch NaOH 0,2M thì thu được những muối gì? Bao nhiêu gam