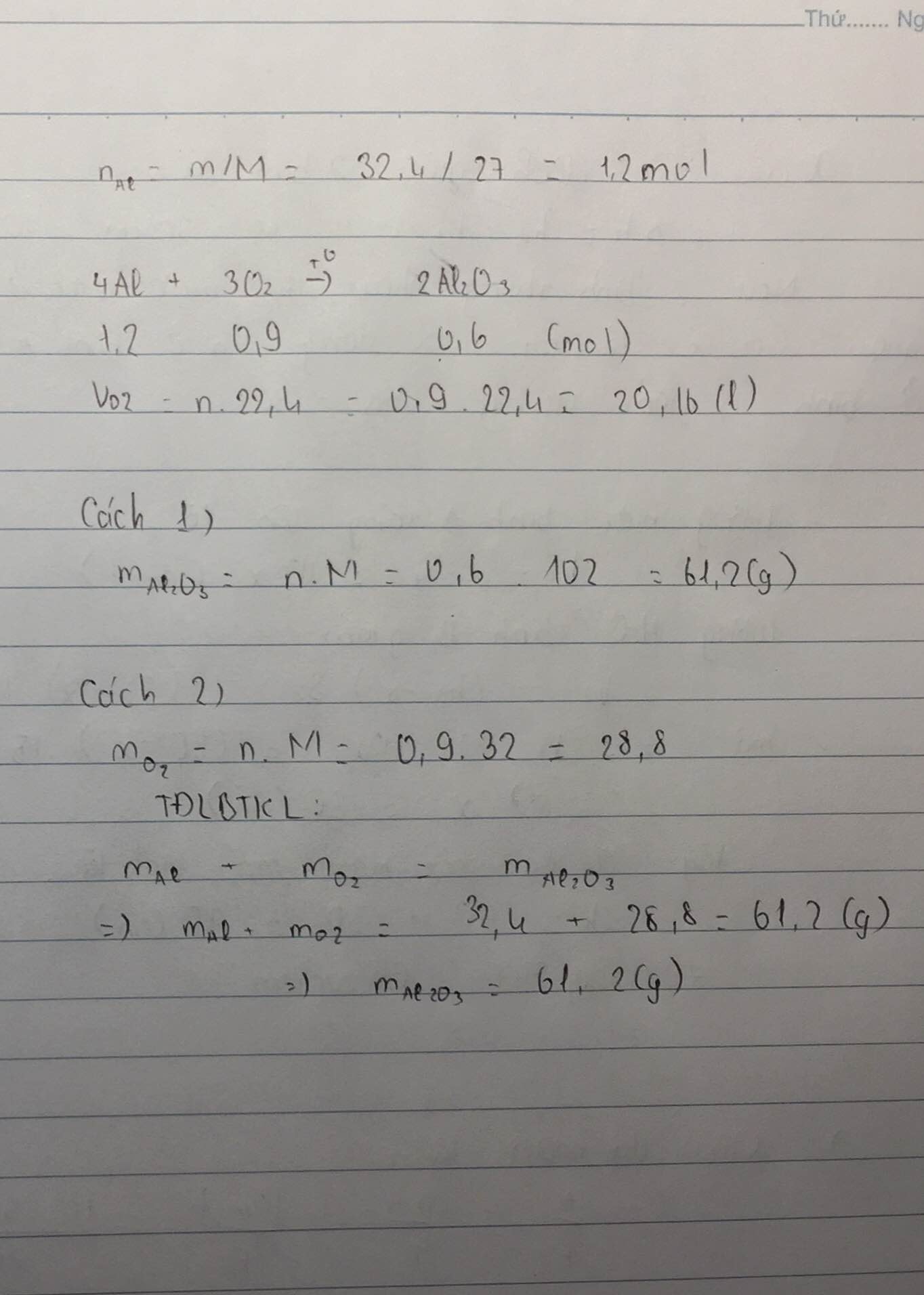đốt cháy 21,6g Al trong O2 thu được Al²O³ tính Vo²,mAl²o³ tính thể tích không khí Vkk=5Vo²

Những câu hỏi liên quan
Đốt cháy 2 1,6g Al trong O2 thủ được Al2O3.Tính Vo2,mal2o3.Tính không khí Vkk=5Vo2
4Al+3O2-to>2al2O3
0,8----0,6---------0,4
n Al=\(\dfrac{21,6}{27}\)=0,8 mol
=>VO2=0,6.22,4=13,44l
m Al2O3=0,4.102=40,8g
=>Vkk=13,44.5=67,2l
Đúng 4
Bình luận (0)
\(m_{Al}=\dfrac{21,6}{27}=0,8\left(mol\right)\)
PTHH: 4Al+3O2\(\underrightarrow{t^o}\)2Al2O3
0,8 0,6 0,4 (mol)
\(V_{O_2}=0,6.22,4=13,44\left(l\right)\\ m_{Al_2O_3}=0,4.102=40,8\left(g\right)\\ V_{kk}=13,44.5=67,2\left(l\right)\)
Đúng 3
Bình luận (0)
Đốt sắt trong O2 ta thu được 23,2g oxit sắt từ Fe3O4. Tính:
a. Khối lượng sắt cần dùng
b. Thể tích khí O2 đã đốt cháy(đktc)
c. Thể tích không khí đã cháy(đktc) biết Vkk=5VO2
Xem chi tiết
nFe3O4 = 23.2/232 = 0.1 mol
3Fe + 2O2 -to-> Fe3O4
0.3____0.2_______0.1
mFe = 0.3*56 = 16.8 g
VO2 = 0.2*22.4 = 4.48 (l)
Vkk = 5VO2 = 22.4 (l)
Đúng 1
Bình luận (0)
\(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
PTHH : \(4Fe+3O_2\rightarrow2Fe_2O_3\)
0,2 0,15 0,1 (mol)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
Đúng 0
Bình luận (0)
Đốt cháy 21,6 gam Al trong không khí dư thu được m gam Al2O3.
a/ Viết PTHH.
b/ Tìm m.
c/ Tính thể tích O2 đã phản ứng (đktc).
d/ Tính thể tích không khí đã dùng (đktc) biết O2 chiếm 20% thể tích không khí.
a: \(4Al+3O_2\rightarrow2Al_2O_3\)
b: \(n_{Al}=\dfrac{21.6}{27}=0.8\left(mol\right)\)
\(\Leftrightarrow n_{Al_2O_3}=0.4\left(mol\right)\)
\(m_{Al_2O_3}=0.4\cdot102=40.8\left(g\right)\)
c: \(n_{O_2}=0.6\left(mol\right)\)
\(V_{O_2}=0.6\cdot22.4=13.44\left(lít\right)\)
Đúng 3
Bình luận (1)
a) 4Al + 3O2 --to--> 2Al2O3
b) \(n_{Al}=\dfrac{21,6}{27}=0,8\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,8-->0,6-------->0,4
=> \(m_{Al_2O_3}=0,4.102=40,8\left(g\right)\)
c) \(V_{O_2}=0,6.22,4=13,44\left(l\right)\)
d) \(V_{kk}=13,44:20\%=67,2\left(l\right)\)
Đúng 4
Bình luận (0)
\(n_{Al}=\dfrac{21,6}{27}=0,8\left(mol\right)\\ a,PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{Al_2O_3}=\dfrac{0,8}{2}=0,4\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,8=0,6\left(mol\right)\\ b,m_{Al_2O_3}=0,4.102=40,8\left(g\right)\\ c,V_{O_2\left(đktc\right)}=0,6.22,4=13,44\left(l\right)\\d, V_{kk\left(đktc\right)}=\dfrac{100}{20}.V_{O_2\left(đktc\right)}=5.13,44=67,2\left(l\right)\)
Đúng 3
Bình luận (0)
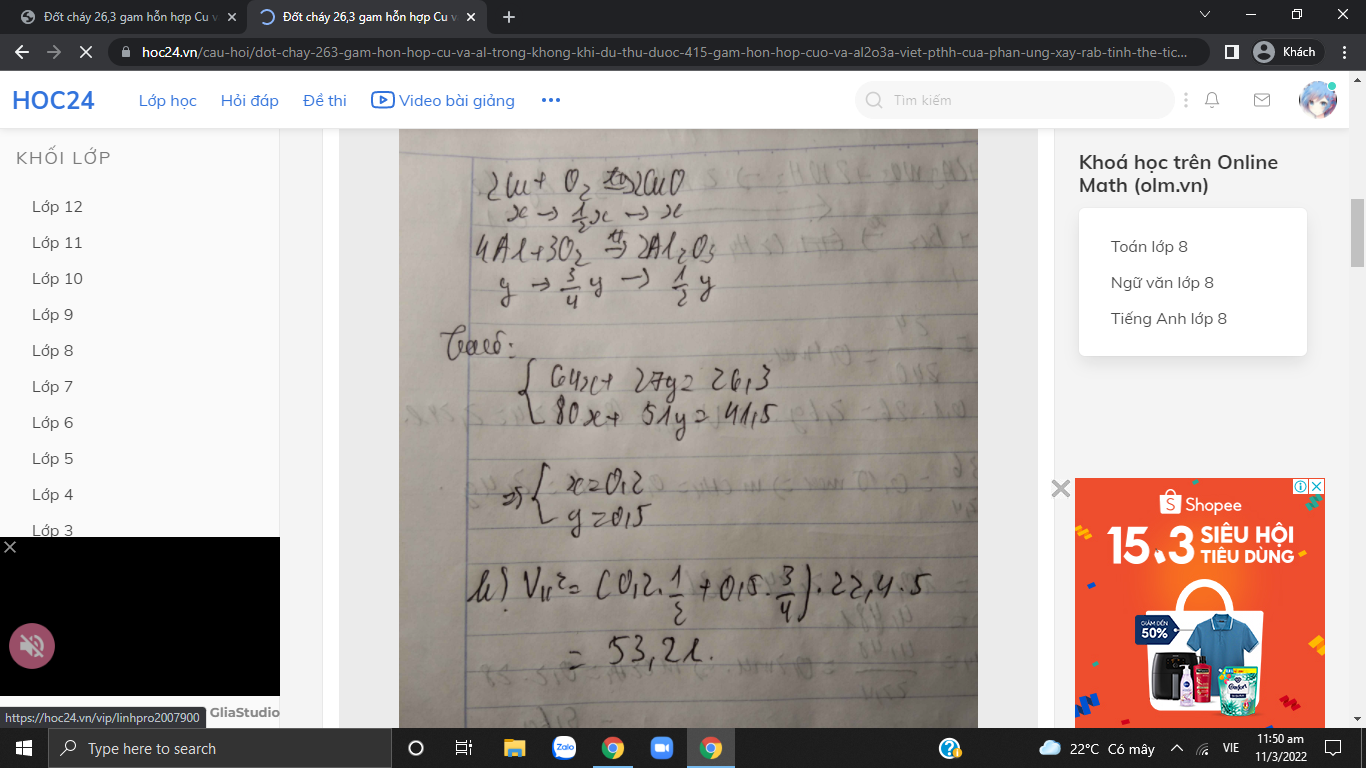
Đốt cháy 26,3 gam hỗn hợp Cu và Al trong không khí (dư) thu được 41,5 gam hỗn hợp
CuO và Al 2 O 3 .
a/ Viết PTHH của phản ứng xảy ra.
b/ Tính thể tích không khí (đktc) đã phản ứng (biết O 2 chiếm 20% thể tích không khí).
a.
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\) \(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
x 1/2x x y 3/4y 1/2y ( mol )
Gọi \(\left\{{}\begin{matrix}n_{Cu}=x\\n_{Al}=y\end{matrix}\right.\)
Ta có:
\(\left\{{}\begin{matrix}64x+27y=26,3\\80x+\dfrac{1}{2}y.102=41,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,5\end{matrix}\right.\)
\(V_{kk}=\left(\dfrac{1}{2}.0,2+\dfrac{3}{4}.0,5\right).22,4.5=0,475.112=53,2l\)
Đúng 3
Bình luận (0)
đốt cháy 10,8g Al . Tình a)khối lượng sp b) thể tích khí oxi cần dùng (đktc) C)thể tích không khí cần dùng đktc biết Vo²=1/5 Vkk
\(n_{Al}=\dfrac{10,8}{27}=0,4mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,4 0,3 0,2 ( mol )
\(m_{Al_2O_3}=0,2.102=20,4g\)
\(V_{O_2}=0,3.22,4=6,72l\)
\(V_{kk}=V_{O_2}.5=6,72.5=33,6l\)
Đúng 1
Bình luận (0)
1) đốt cháy 32,4g Al trong khí O² thu được nhôm oxit (Al²O³).
a) Viết phương trình phản ứng
b) tính thể tích khí O² cần dùng (ở đktc)
c) Tính khối lượng nhôm oxit thu được theo 2 cách.
Đốt cháy Aluminium trong không khí thu được 30,6 gam Aluminium Oxide.
a) Viết PTHH
b) Tính khối lượng Aluminium bị đốt cháy
c) Tính thể tích khí Oxygen cần dùng (đkc) (Al=27,O=16)
\(a,PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{Al_2O_3}=\dfrac{30,6}{102}=0,3\left(mol\right)\\ n_{Al}=\dfrac{4}{2}.n_{Al_2O_3}=2.0,3=0,6\left(mol\right)\\ \Rightarrow m_{Al}=0,6.27=16,2\left(g\right)\\ c,n_{O_2}=\dfrac{3}{2}.n_{Al_2O_3}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\\ \Rightarrow V_{O_2\left(đkc\right)}=0,45.24,79=11,1555\left(l\right)\)
Đúng 2
Bình luận (2)
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(nAl_2O_3=\dfrac{30,6}{102}=0,3\left(mol\right)\)
\(nAl=\dfrac{4}{2}.0,3=0,6\left(mol\right)\)
\(mAl=0,6.27=16,2\left(g\right)\)
c, \(nO_2=\dfrac{3}{2}.0,3=0,45\left(mol\right)\)
\(VO_{2\left(đkc\right)}=0,45.24,79=11,1555\left(l\right)\)
Đúng 0
Bình luận (2)
a) PTHH: \(4Al+3O_2\rightarrow^{t^0}2Al_2O_3\).
b) \(n_{Al_2O_3}=\dfrac{m}{M}=\dfrac{30,6}{102}=0,3\left(mol\right)\)
-Theo PTHH trên, ta có:
\(n_{Al}=\dfrac{n_{Al_2O_3}}{2}.4=\dfrac{0,3}{2}.4=0,6\left(mol\right)\)
\(\Rightarrow m_{Al}=0,6.27=16,2\left(mol\right)\)
c) -Theo PTHH trên, ta có:
\(n_{O_2}=\dfrac{n_{Al_2O_3}}{2}.3=\dfrac{0,3}{2}.3=0,45\left(mol\right)\).
\(\Rightarrow V_{O_2\left(đktc\right)}=n.24,79=0,45.24,79=11,1555\left(l\right)\)
Đúng 2
Bình luận (1)
Đốt cháy hết Al trong O2 thu được 51 gam Al2O3
a)Tính mAl thu được
b)Tính Vo2(đktc) cần dùng
a. PTHH: 4 Al + 3O2 ---> 2Al2O3
0,15 mol 0,1125 mol 0,075 mol
b. + Số mol của Al:
nAl = m/M = 4,05/27 = 0,15 (mol)
+ Khối lượng của Al2O3:
mAl2O3 = n.M = 0,075.102 = 7,65 (g)
Vậy: nếu đốt cháy hết 4,05 g bột Al thì thu được 7,65 g Al2O3
c. + Số g Al cần đốt:
mAl = n.M = 0,15.27 = 1,05 (g)
+ Số lít O2 cần đốt:
VO2 = n.22,4 = 0,1125.22,4 = 2,52 (l)
Vậy: để thu được 25,5 g Al2O3 thì cần đốt cháy hết 1,05 g Al và dùng ít nhất 2,52 lít O2
Note: mình không biết làm vậy đúng không nên trước khi tham khảo bạn hãy kiểm tra lại trước nhé, rồi có gì bảo mình.
Chúc bạn học tốt , và nhớ cho mình 1like nhé !
Đúng 2
Bình luận (1)
còn nếu ko hiểu vào link này : https://olm.vn/hoi-dap/detail/185392011399.html
Đúng 1
Bình luận (0)
PTHH: 4 Al + 3 O2 -to-> 2 Al2O3
Ta có: nAl2O3= 51/102=0,5(mol)
=> nO2= 3/2. 0,5= 0,75(mol); nAl= 4/2. 0,5=1(mol)
a) mAl=1.27= 27(g)
b) V(O2,đktc)=0,75.22,4=16,8(l)
Đúng 1
Bình luận (0)
Đốt cháy hết 21,6g nhôm trong bình chứa khí oxi vừa đủ. Viết phương trình hóa học. Tính thể tích khí oxi tham gia phản ứng (đktc). Tính khối lượng sản phẩm tạo thành. Al = 27 ; O = 16
PTHH : \(4Al+3O_2\rightarrow2Al_2O_3\)( thêm cái t0 ở trên mũi tên hộ mình )
Số mol Al tham gia phản ứng : \(n_{Al}=\frac{m_{Al}}{M_{Al}}=\frac{21,6}{27}=0,8\left(mol\right)\)
Theo PTHH : Cứ 4 mol Al thì tham gia phản ứng với 3 mol O2
=> Cứ 0,8 mol Al thì tham gia phản ứng với 0, 6 mol O2
=> Thể tích khí O2 tham gia phản ứng ( ở đktc ) là : \(V_{O_2}=n_{O_2}\times22,4=0,6\times22,4=13,44\left(l\right)\)
Khối lượng sản phẩm tạo thành = 4Al + 6O2 = 4.27 + 6.16.2 = 300đvC
\(n_{Al}=\frac{21,6}{27}=0,8\left(mol\right)\)
PTHH : \(4Al+3O_2-t^o->2Al_2O_3\)
Theo pthh : \(n_{O_2\left(pứ\right)}=\frac{3}{4}n_{Al}=0,6\left(mol\right)\)
\(n_{Al_2O_3}=\frac{1}{2}n_{Al}=0,4\left(mol\right)\)
=>\(\hept{\begin{cases}V_{O_2\left(pứ\right)}=0,6\cdot22,4=13,44\left(l\right)\\m_{Al_2O_3}=102\cdot0,4=40,8\left(g\right)\end{cases}}\)