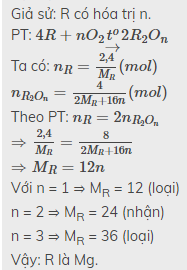Đốt cháy 1,62 gam kim loại A hoá trị 3 trong ko khí thu đc 3,06 gam oxit của nó.Xác định kim loại A

Những câu hỏi liên quan
đốt cháy hoàn toàn 9,75 gam kim loại R trong khí oxi thu được 12,15 gam oxit. xác định tên Kim loại R, biết rằng Kim loại R có hoá trị không đổi
\(n_R=\dfrac{9,75}{R};n_{RO}=\dfrac{12,15}{R+16}\)
\(PTHH:2R+O_2\xrightarrow[]{}2RO\)
tỉ lệ : 2 1 2
số mol :\(\dfrac{9,75}{R}\) \(\dfrac{12,15}{R+16}\)
=>\(\dfrac{9,75}{R}=\dfrac{12,15}{R+16}\)
=>\(R=65\)
Vì kẽm có phân tử khối là 65 và hoá trị không đổi(ll)
=>kim loại R là kẽm(Zn)
Đúng 2
Bình luận (0)
Đốt cháy hết 2,4g một kim loại R(II) thu đc 4g oxit của nó.
xác định kim loại.
Áp dụng ĐLBTKL:
\(m_{O_2}=4-2,4=1,6\left(g\right)\\ \rightarrow n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: \(2R+O_2\xrightarrow[]{t^o}2RO\)
0,1<-0,05
\(\rightarrow M_R=\dfrac{2,4}{0,1}=24\left(g\text{/}mol\right)\)
=> R là Mg
Đúng 1
Bình luận (0)
Đốt cháy 19,2 gam một kim loại R ( có hoá trị || ) trong khí oxi thu được 24 gam oxit. Tìm tên Kim loại R
Vì kim loại có hóa trị II nên áp dụng quy tắc hóa trị
=> CTHH của sản phẩm là: `RO`
\(PTHH:2R+O_2-^{t^o}>2RO\)
tỉ lệ 2 : 1 : 2
n(mol) 0,3<----0,15---->0,3
áp dụng định luật bảo toàn khối lg ta có
\(m_R+m_{O_2}=m_{RO}\\ =>19,2+m_{O_2}=24\\ =>m_{O_2}=4,8\left(g\right)\)
\(n_{O_2}=\dfrac{m}{M}=\dfrac{4,8}{32}=0,15\)
\(M_R=\dfrac{m}{n}=\dfrac{19,2}{0,3}=64\left(g/mol\right)\)
=> R là sắt
Đúng 0
Bình luận (1)
: Đốt cháy 10,8 gam một kim loại M hóa trị III trong không khí thu được 20,4 gam oxit.1. Xác định tên kim loại M.2. Tính thể tích không khí cần dùng để đốt cháy hết lượng kim loại trên (đktc).3. Tính thể tích dung dịch HCl 2M cần dùng để hòa tan hết lượng oxit tạo thành.4. Tính thể tích dung dịch NaOH 25% (D1,25 g/ml) cần dùng để hòa tan hết lượng oxit tạo thành.
Đọc tiếp
: Đốt cháy 10,8 gam một kim loại M hóa trị III trong không khí thu được 20,4 gam oxit.
1. Xác định tên kim loại M.
2. Tính thể tích không khí cần dùng để đốt cháy hết lượng kim loại trên (đktc).
3. Tính thể tích dung dịch HCl 2M cần dùng để hòa tan hết lượng oxit tạo thành.
4. Tính thể tích dung dịch NaOH 25% (D=1,25 g/ml) cần dùng để hòa tan hết lượng oxit tạo thành.
a, PT: \(4M+3O_2\underrightarrow{t^o}2M_2O_3\)
Ta có: \(n_M=\dfrac{10,8}{M_M}\left(mol\right)\)
\(n_{M_2O_3}=\dfrac{20,4}{2M_M+16.3}\left(mol\right)\)
Theo PT: \(n_M=2n_{M_2O_3}\Rightarrow\dfrac{10,8}{M_M}=2.\dfrac{20,4}{2M_M+16.3}\)
\(\Rightarrow M_M=27\left(g/mol\right)\)
→ M là Nhôm (Al)
b, Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,3\left(mol\right)\) \(\Rightarrow V_{O_2}=0,3.22,4=6,72\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=33,6\left(l\right)\)
c, PT: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\)
\(n_{HCl}=6n_{Al_2O_3}=1,2\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{1,2}{2}=0,6\left(l\right)\)
d, PT: \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
Theo PT: \(n_{NaOH}=2n_{Al_2O_3}=0,4\left(mol\right)\)
\(\Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\Rightarrow m_{ddNaOH}=\dfrac{16}{25\%}=64\left(g\right)\)
\(\Rightarrow V_{ddNaOH}=\dfrac{64}{1,25}=51,2\left(ml\right)\)
Đúng 1
Bình luận (0)
đốt cháy 1 kim loại X có hoá trị III tỏng 3,36 lít khí oxi (đktc)thu được 10,2 gam oxit .Tìm tên kim loại X
nO2 = 3,36 : 22,4 = 0,15 (mol)
pthh : 4X + 3O2 -t-> 2X2O3
0,15 0,1
=> MX2O3 = 10,2 : 0,1 = 102 (G/MOL)
=> MX = (102 - 48):2 = 27 (g/mol)
=> X là Al
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 3,9 gam một kim loại M hoá trị I thu được 4,7 gam một oxit A a) cho biết A thuộc loại oxit nào ? Vì sao? Tìm tên kim loại M và cho biết bazơ tương ứng của oxit A
a, Vì M là kim loại hóa trị I nên oxit thu được là oxit bazơ.
b, PT: \(4M+O_2\underrightarrow{t^o}2M_2O\)
Ta có: \(n_M=\dfrac{3,9}{M_M}\left(mol\right)\)
\(n_{M_2O}=\dfrac{4,7}{2M_M+16}\left(mol\right)\)
Theo PT: \(n_M=2n_{M_2O}\)
\(\Rightarrow\dfrac{3,9}{M_M}=\dfrac{2.4,7}{2M_M+16}\)
\(\Rightarrow M_M=39\left(g/mol\right)\)
Vậy: M là Kali (K) và bazơ tương ứng của oxit A là KOH.
Bạn tham khảo nhé!
Đúng 3
Bình luận (0)
Đốt cháy 4,6g một kim loại R hoá trị 1 trong khí O2 thu được 6,2g oxit. Hãy xác định kim loại R
$4R + O_2 \xrightarrow{t^o} 2R_2O$
Theo PTHH :
$n_R = 2n_{R_2O}$
$\Rightarrow \dfrac{4,6}{R} = \dfrac{6,2}{2R + 16}.2$
$\Rightarrow R = 23(Natri)$
Đúng 1
Bình luận (0)
đốt cháy 2,7 gam kim loại nhôm trong bình chứa khí oxi. sau pu thu đc bnh gam oxit
nAl=2,7/27=0,1(mol)
PTHH: 4Al +3 O2 -to-> 2 Al2O3
0,1________________0,05(mol)
mAl2O3=102.0,05=5,1(g)
Đúng 0
Bình luận (0)
\(n_{Al}=\dfrac{2.7}{27}=0.1\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^o}}}Al_2O_3\)
\(0.1......0.075\)
\(V_{O_2}=0.075\cdot22.4=1.68\left(l\right)\)
Đúng 0
Bình luận (1)
đốt cháy 3,5gam kim loại hóa trị I trong khí O2 thu được 7,5 gam oxit. Tìm kim loại hóa trị I
Gọi kim loại cần tìm là R
\(n_R=\dfrac{3,5}{M_R}\left(mol\right)\)
PTHH: 4R + O2 --to--> 2R2O
\(\dfrac{3,5}{M_R}\)------------->\(\dfrac{1,75}{M_R}\)
=> \(\dfrac{1,75}{M_R}\left(2.M_R+16\right)=7,5\)
=> MR = 7 (g/mol)
=> R là Li
Đúng 5
Bình luận (0)
Gọi kim loại hóa trị I là R
PTHH : 4R + O2 -----to---> 2R2O
0,5 0,125
Theo ĐLBTKL : \(m_R+m_{O_2}=m_{R_2O}\\ \Rightarrow m_{O_2}=7,5-3,5=4\left(g\right)\)
\(n_{O_2}=\dfrac{4}{32}=0,125\left(mol\right)\)
\(M_R=\dfrac{3.5}{0,5}=7\left(\dfrac{g}{mol}\right)\)
Vậy R là Liti
Đúng 3
Bình luận (0)