cho hỗn hợp A có khối lượng 2,6g . đốt cháy A thu 1,8g h2o và 8,8g co2 . trong A có nguyên tố nào

Những câu hỏi liên quan
Đốt cháy hoàn toàn hợp chất X có khối lượng 4,6g thì thu được 8,8g CO2 và 5,4g H2O. Hãy xác định:
- Hợp chất X có những nguyên tố nào?
- CTHH của X, biết tỉ khối của X với H2 là 23.
- Đốt X thu CO2 và H2O. → X chứa C và H, có thể có O.
Ta có: \(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
⇒ mC + mH = 0,2.12 + 0,6.1 = 3 (g) < 4,6 (g)
→ X gồm: C, H và O.
mO = 4,6 - 3 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
- Gọi: CTHH của X là CxHyOz.
\(\Rightarrow x:y:z=0,2:0,6:0,1=2:6:1\)
→ CTĐGN của X là (C2H6O)n.
Mà: \(M_X=23.2=46\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{46}{12.2+6+16}=1\)
Vậy: CTHH của X là C2H6O.
Đúng 2
Bình luận (0)
đốt cháy hoàn toàn một hỗn hợp 20 hidrocacbon khác nhau thu được 8,8g co2 và 1,8g h2o thì số lít (đktc) khí oxi cần dùng là
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
Bảo toàn O: \(n_{O_2}=\dfrac{0,2.2+0,1.1}{2}=0,25\left(mol\right)\)
=> \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 3
Bình luận (0)
Đốt cháy 2,8g h/c h/c A Thu được 13,2 gam CO2 và 1,8g H2O a, A có những nguyên tố nào? b, Tìm CTPT của A (MAb=44g/mol)
\(n_{CO_2}=\dfrac{13,2}{44}=0,3mol\Rightarrow n_C=0,3mol\Rightarrow m_C=3,6g\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1mol\Rightarrow n_H=0,2mol\Rightarrow m_H=0,2g\)
Có \(m_C+m_H=3,8g>m_A=2,8g\Rightarrow\)đề vô lí
Đúng 0
Bình luận (0)
1) Phân tích một hợp chất hóa học, thấy có 3 nguyên tố hóa học là C, H, và O. Đốt cháy hoàn toàn 1,24g hợp chất thì thu được 1,76g CO2 và 1,8g H2O. Xác định công thức phân tử của hợp chất, biết khối lượng mol của hợp chất bằng 62g.2) Đốt cháy hoàn toàn cacbon bằng lượng khí oxi dư, người ta được hỗn hợp khí cacbonic và khí oxi.a) Xác định thành phần phần trăm theo số mol của khí oxi trong hỗn hợp có 0,3.1023 phân tử CO2 và 0,9.1023 phân tử O2.b) Trình bày phương pháp hóa học tách riêng khí oxi v...
Đọc tiếp
1) Phân tích một hợp chất hóa học, thấy có 3 nguyên tố hóa học là C, H, và O. Đốt cháy hoàn toàn 1,24g hợp chất thì thu được 1,76g CO2 và 1,8g H2O. Xác định công thức phân tử của hợp chất, biết khối lượng mol của hợp chất bằng 62g.
2) Đốt cháy hoàn toàn cacbon bằng lượng khí oxi dư, người ta được hỗn hợp khí cacbonic và khí oxi.
a) Xác định thành phần phần trăm theo số mol của khí oxi trong hỗn hợp có 0,3.1023 phân tử CO2 và 0,9.1023 phân tử O2.
b) Trình bày phương pháp hóa học tách riêng khí oxi và khí cacbonic ra khỏi hỗn hợp.
Câu 2 :
a)
\(n_{CO_2} = \dfrac{0,3.10^{23}}{6.10^{23}} = 0,05(mol)\\ n_{O_2} = \dfrac{0,9.10^{23}}{6.10^{23}} = 0,15(mol)\)
Vậy :
\(\%n_{CO_2} = \dfrac{0,05}{0,15+0,05}.100\% = 25\%\\ \%n_{O_2} = 100\% - 25\% = 75\%\)
b)
Sục hỗn hợp vào dung dịch Ca(OH)2 lấy dư,thu lấy khí thoát ra ta được O2.Lọc dung dịch,thu lấy kết tủa
\(Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O\)
Cho kết tủa vào dung dịch HCl lấy dư, thu lấy khí thoát ra. Ta thu được khí CO2
\(CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O\)
Đúng 3
Bình luận (4)
Bài 4: Một hợp chất hữu cơ A gồm 2 nguyên tố. Đốt cháy 2,6g A thu được 1,8g nước. Xác định CTPT của A. Biết tỉ khối của A đối với H2 là 13.
Đốt cháy A thu được sản phẩm chứa nguyên tố H (H2O)
=> Trong A chứa H
Mà A là hợp chất hữu cơ
=> A chứa C, H
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
=> nH = 0,2 (mol)
=> \(n_C=\dfrac{2,6-0,2.1}{12}=0,2\left(mol\right)\)
Xét nC : nH = 0,2 : 0,2 = 1 : 1
=> CTPT: (CH)n
Mà MA = 13.2 = 26 (g/mol)
=> n = 2
=> CTPT: C2H2
Đúng 2
Bình luận (0)
Đốt cháy 4,4 gam hợp chất hữu cơ A, thu được 8,8g khí Co2 và 7,2g H2O
a) Trong chất hữu cơ A có những nguyên tố nào? b) Biết tỉ khối của A so với hiđro là 22. Tìm công thức phân tử của A
Đốt cháy hoàn toàn m gam hỗn hợp X gồm 3 este thu đc 8,8g CO2 và 2,7g H2O. Biết oxi chiếm 25% về khối lượng của hỗn hợp X . Khối lượng 3 este đem đốt là?
$n_{CO_2} = 0,2(mol) ; n_{H_2O} = 0,15(mol)$
Gọi $n_{O(trong\ X} = a(mol) ; n_{O_2} = b(mol)$
Bảo toàn O : $a + 2b = 0,2.2 + 0,15$
Bảo toàn khối lượng : $\dfrac{16a}{25\%} + 32b = 8,8 + 2,7$
Suy ra a = 0,05625
Suy ra $m_{este} = \dfrac{0,05625.16}{25\%} = 3,6(gam)$
Đúng 1
Bình luận (0)
Các Hiđrocacbon A, B thuộc dãy anken hoặc ankin. Đốt cháy hoàn toàn 0,05 mol hỗn hợp A, B thu được khối lượng CO2 và H2O là 15,14 gam, trong đó oxi chiếm 77,15%. Nếu đốt cháy hoàn toàn 0,05 mol hỗn hợp A, B có tỉ lệ mol thay đổi ta vẫn thu được một lượng khí CO2 như nhau. Tổng số nguyên tử cacbon trong A và B là: A. 10 B. 9 C. 11 D. 12
Đọc tiếp
Các Hiđrocacbon A, B thuộc dãy anken hoặc ankin. Đốt cháy hoàn toàn 0,05 mol hỗn hợp A, B thu được khối lượng CO2 và H2O là 15,14 gam, trong đó oxi chiếm 77,15%. Nếu đốt cháy hoàn toàn 0,05 mol hỗn hợp A, B có tỉ lệ mol thay đổi ta vẫn thu được một lượng khí CO2 như nhau. Tổng số nguyên tử cacbon trong A và B là:
A. 10
B. 9
C. 11
D. 12
Đáp án A
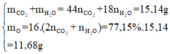
![]()
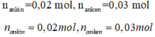
· Đặt CTPT của ankin là CnH2n-2; anken là CmH2m
0,02n + 0,03m = 0,25 2n + 3m = 25
· Do tỉ lệ số mol A, B thay đổi mà số mol CO2 không đổi n = m
Tổng số nguyên tử C trong A và B là 10
Đúng 0
Bình luận (0)
Đốt cháy 4,6g A có Ct CXHyO cần 6,72 lít 02 (đktc) thu đc 8,8g CO2 và 1 lượng H2O .Tính khối lượn H2O và CTPT
Số mol O2=0,3mol
Số mol CO2=0,2mol
Bảo toàn khối lượng
m(H2O)=4,6+0,3.32-8,8=5,4g
Số mol h2o=0,3mol
Bảo toàn ngto O
nO= 2.0,2+0,3-0,3.2=0,1mol
nC:nH:nO=2:6:1
=> công thức C2H6O
Đúng 3
Bình luận (0)
Bảo toàn khối lượng :
\(m_{H_2O}=4.6+0.3\cdot32-8.8=5.4\left(g\right)\)
Bảo toàn nguyên tố O:
\(n_A=0.2\cdot2+0.3-0.3\cdot2=0.1\left(mol\right)\)
\(x=\dfrac{0.2}{0.1}=2\)
\(y=\dfrac{0.3}{0.1}=3\)
\(CTPT:C_2H_3O\)
Đúng 0
Bình luận (1)
























